
 氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O
氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O分析 (1)Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,Ni失去4s能级2个电子形成Ni2+;
(2)CH3NC中甲基上的碳是sp3 杂化,而碳氮叁键中的碳是sp杂化;1molCH3NC中σ键的5mol;
(3)①原子数和价电子数都相等的微粒互为等电子体;
②分子间存在氢键溶解性增强;
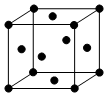
(4)利用均摊法计算晶胞中Ni原子个数.
解答 解:(1)Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,Ni失去4s能级2个电子形成Ni2+,Ni2+离子核外电子排布式为:1s22s22p63s23p63d8,所以Ni2+基态核外电子排布式为3d8,故答案为:3d8;
(2)CH3NC中甲基上的碳是sp3 杂化,而碳氮叁键中的碳是sp杂化,1molCH3NC中σ键的5mol;故答案为:sp、sp3;5mol;
(3)①原子数和价电子数都相等的微粒互为等电子体,与COCl2互为等电子体的阴离子的化学式为CO32-或NO3-,故答案为:CO32-或NO3-;
②因为甲胺能与水形成分子间氢键,所以甲胺极易溶于水,故答案为:甲胺能与水形成分子间氢键;
(4)每个晶胞中镍原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4.
点评 本题考查原子核外电子的排布和晶胞的计算,利用均摊法来分析解答即可,难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:实验题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的 pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至 10 倍后 pH=4 | |
| C. | pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7 | |
| D. | pH 均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先加硝酸,再滴加BaCl2溶液 | 产生白色沉淀 | 原溶液中一定有SO42- |
| B | 先加入H2O2溶液,再加KSCN溶液 | 溶液呈血红色 | 原溶液中一定有Fe2+ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中一定有Na+、无K+ |
| D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中一定有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH3分子中所有原子在一个平面上 | |
| B. | 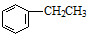 的同分异构体中,苯环上的一氯代物只有一种的结构有4种 的同分异构体中,苯环上的一氯代物只有一种的结构有4种 | |
| C. | CH2=CHCH2OH能发生加成发应、取代反应、氧化反应等 | |
| D. | 苯乙烯(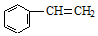 )能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4mol Br2 )能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①⑥ | C. | ① | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入净水剂明矾可以使海水淡化 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 海水淡化的方法主要有电渗析法、蒸馏法、离子交换法等 | |
| D. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com