
【题目】由SO2和O2制备SO3(熔点16.8 ℃,沸点44.8 ℃)的模拟装置如图所示(加热和夹持装置省略):
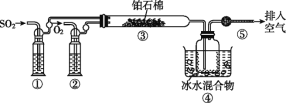
下列说法正确的是( )
A.装置①中的试剂为饱和NaHSO3溶液
B.实验室可用铜与浓硫酸在常温条件下制取SO2
C.装置③反应管中的铂石棉用作反应的催化剂
D.从装置⑤逸出的气体有过量的SO2和O2
科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:
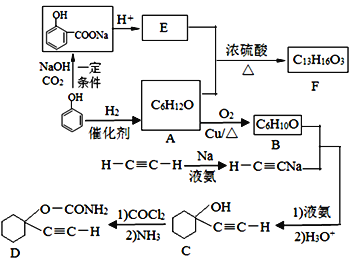
(1)A的化学名称是___,C中含氧官能团的名称为_____。
(2)F的结构简式为____,A和E生成F的反应类型为____。
(3)A生成B的化学方程式为________。
(4)写出由C合成D的第二个反应的化学方程式:________。
(5)同时满足下列条件的E的同分异构体有___种(不含立体异构)。
①遇FeCl3溶液发生显色反应;
②能发生银镜反应
(6)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_____。
(7)
乙炔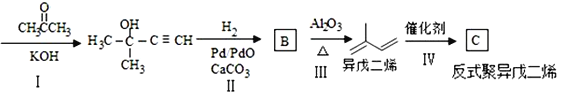
①写出C的结构简式:___
②写出从I至IV的反应类型分别为:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、 E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
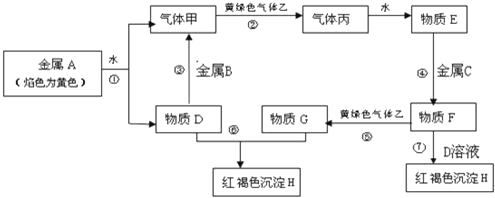
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B__________、丙__________。
(2)说出黄绿色气体乙的一种用途:________________。反应过程⑦可能观察到的实验现象是________________。
(3)反应①的离子方程式为________________。
(4)反应③中的氧化剂是____________(写化学式,下同)反应④中的还原剂是____________。
(5)写出反应⑤的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法中,正确的是( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 2-甲基丁烷也称为异丁烷
C. ![]() 和
和![]() 互为同系物
互为同系物
D. CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14gC2H4含有的单键数目为3NA
B.99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
D.100 g CaS与CaSO4的混合物中含有32 g硫,则含有的氧原子数为1.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构的有关性质和特点,回答下列问题:
(1)基态氮原子的外围电子排布图为_____________,基态镁原子核外电子有__________种空间运动状态。
(2)丙烯腈(CH2=CH-CN)分子中碳原子轨道杂化类型是____________,H、C、N元素的电负性由大到小的顺序为___________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。该配合物中阴离子的空间构型为___________,与其互为等电子体的分子或离子是____________(各举1例)。
(4)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0pm,密度为__________g/cm3(列出计算式即可),a位置S2-离子与b位置Zn2+离子之间的距离为__________pm。
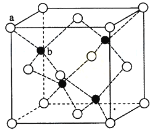
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大。A原子是元素周期表中原子半径最小的原子;B可以与A形成常温下常见的液态物质;C原子的最外层电子数为比最内层电子数少1;D单质在空气中点燃发出耀眼的白光;E是第3周期非金属性最强的元素。
(1)A、B形成的具有强氧化性的18电子的物质的电子式为:___________
(2)C、D最高价氧化物的水化物的碱性__>__。(填化学式)
(3)B、C形成的简单离子半径大小__>__。(填具体离子符号)
(4)E的最高价氧化物的水化物与D的最高价氧化物的水化物在溶液中反应的离子方程式___________
(5)写出化合物CE的形成过程为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是
A.  配制0.10mol·L-1 NaOH溶液
配制0.10mol·L-1 NaOH溶液
B. 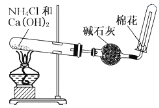 实验室制取干燥的氨气
实验室制取干燥的氨气
C.  萃取碘水中I2,分出水层后的操作
萃取碘水中I2,分出水层后的操作
D. 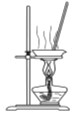 蒸干FeCl2溶液制取FeCl2·4H2O
蒸干FeCl2溶液制取FeCl2·4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com