

分析 A元素可形成自然界硬度最大的单质,该单质为金刚石,则A为C元素;B与A同周期,核外有三个未成对电子,则B为N元素;根据X原子的第一电离能至第四电离可知,X原子的第四电离能剧增,则X表现+3价,所以X为Al元素;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质,则Y为S元素;Z的一种同位素的质量数为63、中子数为34,则质子数=63-34=29,故Z为Cu元素,据此进行解答.
解答 解:A元素可形成自然界硬度最大的单质,该单质为金刚石,则A为C元素;B与A同周期,核外有三个未成对电子,则B为N元素;根据X原子的第一电离能至第四电离可知,X原子的第四电离能剧增,则X表现+3价,所以X为Al元素;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质,则Y为S元素;Z的一种同位素的质量数为63、中子数为34,则质子数=63-34=29,故Z为Cu元素.
(1)AY2化学式是CS2,其结构式为S=C=S,为直线型结构,属于非极性分子,其分子中每个双键中含有1个σ键,所以CS2分子存在2个σ键,故答案为:非极性;2;
(2)X是Al元素,铝与NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
XB是CN,晶体与金刚石类似,属于原子晶体;
B的最简单氢化物是NH3,N原子电负性大,分子间形成氢键,所以容易液化,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;原子;分子间形成氢键;
(3)非金属性越强,电负性越强,Al、O、N元素的电负性与非金属性一致,则三种元素电负性大到小顺序为:O>N>Al,故答案为:O>N>Al;
(4)Z为29号Cu元素,根据构造原理,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1;?
①O2中氧元素的化合价是0价,HO2中氧元素的平均化合价是-0.5价,化合价降低作氧化剂,故①正确;?
②HO2为超氧酸,应具有酸性,可与碱反应,故HO2在碱中不能稳定存在,故②正确;
③还原产物是HO2,故③错误;
④1molCu参加反应生成+1价铜离子,有1mol电子发生转移,故④正确,
故答案为:1s22s22p63s23p63d104s1;③;
(5)Z为Cu元素,铜原子位于顶点和面心,每个晶胞中含有铜原子的数目为:8×$\frac{1}{8}$+6×$\frac{1}{4}$=4,晶胞中含有4个铜原子,则晶胞的质量为:$\frac{64×4}{{N}_{A}}$g,设该晶胞的边长为xcm,则该晶胞体积为:x3cm3,则:$\frac{64×4}{{N}_{A}}$g=x3cm3×9.00g/cm3,整理可得x=$\root{3}{4.72×1{0}^{-23}}$;
SO42-离子的中心原子S的价层电子对为:4+$\frac{6+2-2×4}{2}$=4,孤电子对数为0,故其空间结构为正四面体,S原子杂化方式为:sp3,
故答案为:$\root{3}{4.72×1{0}^{-23}}$;正四面体;sp3.
点评 本题是对物质结构的考查,涉及核外电子排布、分子结构与性质、杂化方式、晶胞计算等,(5)中晶胞的计算为难点、易错点,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 惰性电极A为阳极,惰性电极B为阴极 | |
| B. | 电解过程中Li+向A电极迁移 | |
| C. | 阳极电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | B极区电解液为LiOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
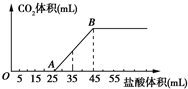
| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO${\;}_{3}^{2-}$+H+═HCO${\;}_{3}^{-}$ | |
| B. | 当加入35 mL盐酸时,产生CO2的体积为224 mL | |
| C. | A点溶液中的溶质为NaCl、NaHCO3 | |
| D. | 混合物中NaOH的质量0.60 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W) | |
| B. | 氢气在R的单质中燃烧火焰呈蓝色 | |
| C. | 元素X的氢化物的稳定性比Y的弱 | |
| D. | Y与Z形成的两种化合物中的化学键类型均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取钢化玻璃的原料为石灰石、纯碱和石英 | |
| B. | 钢化玻璃是一种新型无机非金属材料 | |
| C. | 制取钢化玻璃的主要反应都是非氧化还原反应 | |
| D. | 在碳素钢中加入镍等合金元素可以制得不锈钢及各种特种钢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com