
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
|
| A. | pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH﹣)=c(H+) |
|
| B. | 在0.1 mol•L﹣1Na2CO3溶液中:c(OH﹣)﹣c(H+)=c(HCO3﹣)+2c(H2CO3) |
|
| C. | 已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH¯)>c(N3¯)>c(H+) |
|
| D. | 0.2 mol•L﹣1NaHCO3溶液中加入等体积0.1 mol•L﹣1NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+) |
| 离子浓度大小的比较.. | |
| 分析: | A.如果酸是强酸,二者恰好反应生成正盐,溶液呈中性,如果酸是弱酸,二者等体积混合时酸过量; B.根据质子守恒判断; C.NaN3是强碱弱酸盐,叠氮酸根离子水解而使其溶液呈碱性,再结合电荷守恒判断; D.二者混合时溶液中的溶质是等物质的量浓度的碳酸钠和碳酸氢钠,碳酸根离子水解程度大于碳酸氢根离子,溶液呈碱性. |
| 解答: | 解:A.如果酸是强酸,二者恰好反应生成正盐,溶液呈中性c(OH﹣)=c(H+),如果酸是弱酸,二者等体积混合时酸过量,则c(OH﹣)<c(H+),故A错误; B.根据质子守恒得c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3),所以c(OH﹣)﹣c(H+)=c(HCO3﹣)+2c(H2CO3),故B正确; C.NaN3是强碱弱酸盐,叠氮酸根离子水解而使其溶液呈碱性c(OH¯)>c(H+),再结合电荷守恒得c(Na+)>c(N3¯),叠氮酸根离子能水解但程度较小,所以c(OH¯)<c(N3¯),故C错误; D.二者混合后,NaOH会反应掉一半的NaHCO3,溶液中的溶质是等物质的量浓度,Na2CO3和NaHCO3,碳酸根离子水解程度大于碳酸氢根离子,所以c(CO32﹣)<c(HCO3﹣),溶液呈碱性,故D错误; 故选B. |
| 点评: | 本题考查了离子浓度大小的比较,明确混合溶液中的溶质及其性质是解本题关键,再结合电荷守恒和物料守恒分析解答,易错选项是D,注意根据碳酸根和碳酸氢根离子的水解程度相对大小判断,为易错点. |


科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4﹣+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
|
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4﹣在反应中失去5mol电子 |
|
| C. | 该反应右框内的产物是OH﹣ | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA代表阿伏加德罗常数.下列说法正确的是( )
|
| A. | 9g重水(D2O)中所含质子数为0.5×6.02×1023 |
|
| B. | 电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g |
|
| C. | 往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA |
|
| D. | VL a mol•L﹣1的氯化铁溶液中,若Fe3+的数目为NA,则Cl﹣的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )
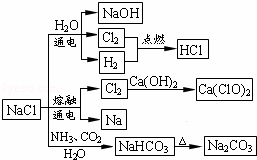
|
| A. | 石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
|
| B. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
|
| C. | 常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
|
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法下列正确的是
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32—、SO32—、SO42—、C1—、NO2-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42—
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+ 、Na+、K+和C1—
查看答案和解析>>
科目:高中化学 来源: 题型:
有些化学反应不论反应物量的多少,都只能用同一个离子方程式来表示。下列各组在溶液中的反应不符合这一情况的是( )
A.Ba(OH)2与H2SO4 B.KMnO4和H2O2
C.HCl与NaHCO3 D.Ca(HCO3)2与Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com