
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
【答案】Cl2、H+ Cl2 氧化性、酸性 酸性 既有氧化性又有还原性 MnO4- HBr 40.5 还原性、酸性
【解析】
(1)根据元素的化合价和物质的性质分析;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应;
③2HCl![]() H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
(3)同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(4)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,根据方程式计算。
(1)在Cl2、Cl-、H+中,氢元素处于最高价具有氧化性,氯气容易得电子具有较强的氧化性,所以具有氧化性的是Cl2、H+,其中氧化性最强的是Cl2,故答案为:Cl2、H+;Cl2;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低,则体现其氧化性,反应中生成盐,还表现酸性,故答案为:氧化性、酸性;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,表现酸性;故答案为:酸性;
③2HCl![]() H2↑+Cl2↑,H元素的化合价降低,Cl元素的化合价升高,所以HCl表现了氧化性、还原性,故答案为:既有氧化性又有还原性;
H2↑+Cl2↑,H元素的化合价降低,Cl元素的化合价升高,所以HCl表现了氧化性、还原性,故答案为:既有氧化性又有还原性;
(3)铁钉在氯气中被锈蚀成棕褐色物质(FeCl3),Cl2表现氧化性,而在盐酸中生成浅绿色溶液(FeCl2),H+具有氧化性,且氧化性Cl2>H+;浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2),则证明氧化性是MnO4->Cl2,所以氧化性顺序是:MnO4->Cl2>H+,所以氧化性最强的是MnO4-,故答案为:MnO4-
(4)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,且做还原剂的只占参加反应的HBr的![]() ;
;
设:消耗15.8 g氧化剂,则被氧化的还原剂的质量是x
2KMnO4 +16HBr═5Br2+2MnBr2+2KBr+8H2O
158×2 81×16×![]()
15.8g x 解得:x=![]() =40.5g
=40.5g
反应中HBr被氧化为Br2,HBr表现还原性;有MnBr2、KBr(盐)生成,HBr表现出了酸性;
故答案为:HBr;40.5;还原性、酸性。


科目:高中化学 来源: 题型:
【题目】某兴趣小组采用以下装置进行铁粉和水蒸气的实验,并对反应后的产物进行探究.
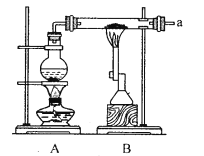
(1)铁粉与水蒸气反应的化学方程式为______;烧瓶中加入沸石的目的是_______
(2)用下图装置检验生成气体,连接顺序为(用字母表示)a![]() _______。
_______。
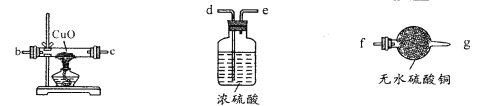
(3)证明反应后的固体中存在二价铁(限选试剂:1mol/LH2SO4、2mol/LHNO3、3%H2O2、0.01mol/LKMnO4、NaOH稀溶液、20%KSCN溶液、Fe2(SO4)3溶液)
步骤一:取反应后固体浸入Fe2(SO4)3溶液,充分反应后过滤并洗涤固体,其目的是_______;
步骤二:取过滤后所得固体加入过量_______,过滤;
步骤三:___________。
(4)取B中反应后的固体加足量稀硫酸溶解,再先后滴加KSCN溶液和氯水,溶液红色加深。请从平衡角度解释红色变深的原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化碘是一种红棕色液体,不溶于水,溶于乙醇和乙酸,能与KI反应生成I2,用于测定油脂中的碘值等(注:碘值表示有机物中不饱和程度的指标)。某校研究性学习小组的同学拟制备一氯化碘(沸点101 ℃)。回答下列问题:
(1)甲组同学拟利用干燥纯净的氯气与碘反应制备一氯化碘,已知碘与氯气的反应为放热反应,其装置如下:
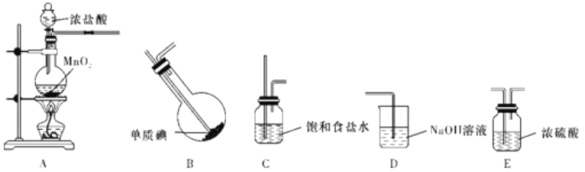
①各装置连接顺序为A→_______________________;
A中发生反应的离子方程式为________________________。
②B装置烧瓶需放在冷水中,其目的是________________________;
D装置的作用是________________________。
③B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_____。
(2)乙组同学采用最新报道制一氯化碘的方法,在三颈烧瓶中加入粗碘和盐酸,控制温度约50 ℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,则发生反应的化学方程式为_________________________。
(3)设计实验证明:ICl的氧化性比I2强:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的位置为_____________。
(2)X、Y、Z、M的原子半径由大到小排列为____(化学用语回答),Z在自然界中常见的二元化合物是__________。
(3)X与M的单质在高温下反应的化学方程式为_______,产物分子的电子式为_____,其化学键属__________共价键(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
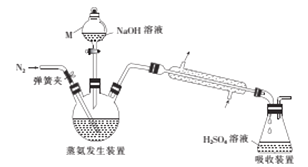
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
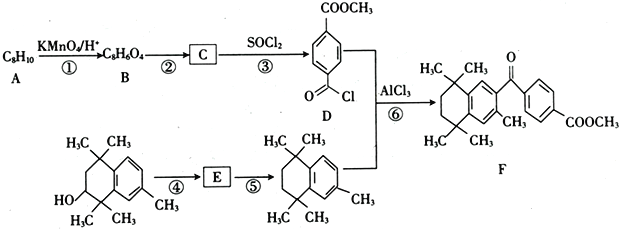
【题目】研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):
已知:Ⅰ. 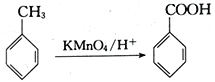
Ⅱ. 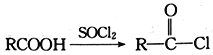
回答下列问题:
(1)B的名称是____________________。
(2)反应②和⑤所属的反应类型分别为____________、_____________。
(3)反应④所需的条件为___________,E分子中官能团的名称为_________________。
(4)反应⑥的化学方程式为________________________________。
(5)芳香族化合物X是C的同分异构体,X只含一种官能团且1mol X与足量NaHCO3溶液发生反应生成2 molCO2,则X的结构有__________种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3 :2 : 2 :1的结构简式为____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
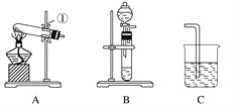
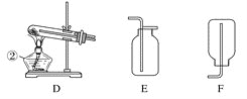
(1)写出仪器名称:①________,②________。
(2)实验室制取并收集氧气时,应选择____________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验时,应选择________和________相连接,检验生成气体时使用的试剂是________,检验气体时观察到的实验现象是_________________。
(4)制取氢气并做还原氧化铜的实验时,应选择______和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.8 g CO和H2混合气体,在足量的氧气中燃烧,产物全部通过足量的Na2O2,则Na2O2增重
A. 2 g B. 3.8 g C. 5 g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)十3c(HCO3-)+3c(H2CO3)
C. 0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D. 0.1mol/LNa2C2O4溶液与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com