
【题目】化学与生活.生产密切相关,下列有关叙述正确的是
A.氢氧化铝.小苏打.纯碱均可用作胃酸中和剂
B.古代的陶瓷.水泥.石英玻璃等,都是硅酸盐产品
C.将草木灰(含K2CO3)与NH4Cl混合使用会降低肥效
D.石油的分馏.煤的干馏等物理变化在生产中有着重要的地位
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 用量筒量取25 mL蒸馏水 B. 用分液漏斗分离乙醇和水
C. 用烧杯溶解FeCl3试样 D. 用托盘天平称量NaCl固体5.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
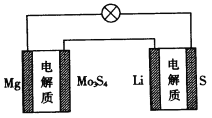
【题目】已知:镁电池的总反应为xMg+Mo3S4![]() MgxMo3S4,锂硫电池的总反应为2Li+S
MgxMo3S4,锂硫电池的总反应为2Li+S![]() Li2S。下列说法正确的是
Li2S。下列说法正确的是
A.镁电池放电时,Mg2+向负极迁移
B.镁电池放电时,正极发生的电极反应为Mo3S4+2xe-= Mo3S42-
C.理论上两种电池的比能量相同(参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量)
D.图中Li作负极,Mo3S4作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。

(1)A装置为CO2的发生装置,其中放置稀盐酸和大理石的仪器名称分别为 ; ,其离子方程式为______________;
(2)B装置可除去A装置中可能挥发出的 (填化学式),其离子方程式为 ,D装置可除去C装置中未反应的 (填名称),其离子方程式为 。
(3)常温下,测得E中生成氧气体积为36.9L (常温下Vm=24.6L/mol),则被还原的过氧化钠质量为 克。
(4)C装置中固体由淡黄色完全变为白色,检验固体成分中有NaOH的实验方案为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列结构的物质:①CH3(CH2)3CH3
②CH3CH2CH2CH2CH3
③CH3CH2CH2CH2CH2CH3
④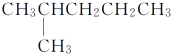
⑤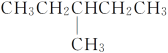
⑥
⑦
其中,属于同系物的是________;属于同分异构体的是__________;属于同种物质的是________。
A①② B②③ C③④⑤⑥⑦ D①③ E③④⑤⑦ F④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
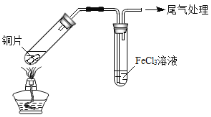
A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式: 。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com