
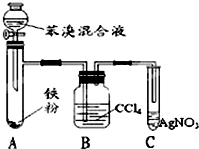
 如表是A、B、C三种烃的有关信息;
如表是A、B、C三种烃的有关信息;| A | B | C |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  | 1棍模型为: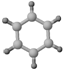 ②平面型结构 | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与H2在一定条件下反应生成A |
 .
. .
. .
.分析 由比例模型可知A为乙烯,B为苯,C为乙炔,
(1)乙烯通入溴的四氯化碳溶液中,乙烯与溴发生加成反应,含碳碳双键,发生加聚反应生成聚乙烯;
(2)B为苯,为无色有刺激性气味的液体、有毒、不溶于水、密度比水小、与酸性KMnO4溶液不反应、在一定条件下与氢气发生加成反应,苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应;
(3)实验室用碳化钙和水反应制备乙炔;
(4)苯与液溴在催化剂条件下发生取代反应生成溴苯和HBr,用四氯化碳除去溴,用硝酸银验证生成HBr,以此解答该题.
解答 解:由比例模型可知A为乙烯,B为苯,C为乙炔,
(1)乙烯通入溴的四氯化碳溶液中,乙烯与溴发生加成反应,该反应为:CH2=CH2+Br2→CH2BrCH2Br,含碳碳双键,发生加聚反应生成聚乙烯,该加聚反应为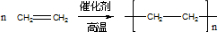 ,
,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;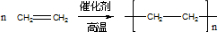 ;
;
(2)B为苯,为无色有刺激性气味的液体、有毒、不溶于水、密度比水小、与酸性KMnO4溶液不反应、在一定条件下与氢气发生加成反应,苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应,即
故答案为:②③;
(3)实验室用碳化钙和水反应制备乙炔,方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(4)①苯与液溴在铁做催化剂条件下发生取代反应化学方程式为: ;
;
故答案为: ;
;
②溴化氢与硝酸银反应生成浅黄色的溴化银和硝酸,且溴化银不溶于硝酸;C中生成了淡黄色沉淀,证明反应中生成了溴化氢,且导管口有白雾出现,
故答案为:导管口有白雾出现,溶液出现淡黄色沉淀;
③溴易挥发,易溶于四氯化碳,用四氯化碳吸收挥发出来的溴;
故答案为:吸收挥发出来的溴.
点评 本题综合考查有机物的结构、性质以及制备,侧重学生的分析能力和实验能力的考查,注意把握有机物的结构以及官能团的性质,把握实验的原理和操作方法,难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: | |
| C. | 四氯化碳的电子式: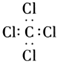 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水蒸气分子中因存在氢键,所以水的沸点很高 | |
| B. | 用电子式表示H2O的形成过程: | |
| C. | 碱金属的熔点、沸点随原子序数的递增而升高,卤素单质的熔点、沸点随原子序数的递增而降低 | |
| D. | 卤素单质的氧化性随原子序数的逐渐增大而增强,其卤化氢的沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
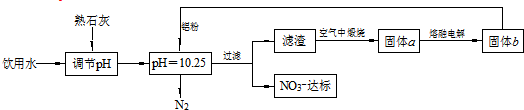
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无毒 | |
| D. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com