
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| 各个生成物平衡浓度系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
| m |
| V |


科目:高中化学 来源: 题型:
 和
和 D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇查看答案和解析>>
科目:高中化学 来源: 题型:
 A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:
 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和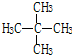
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热时1 mol Fe与1 mol Cl2能恰好完全反应生成1 mol FeCl2,转移电子数为2NA |
| B、标准状况下,22.4L己烷中含碳原子数为6NA |
| C、30g甲醛中含共用电子对总数为3NA |
| D、3.9g Na2O2与3.1g Na2O组成的混合物中所含离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、286g Na2CO3?10H2O固体中含有NA个阴离子 |
| B、9.2g金属钠投入到足量的重水中,则产生的气体中含有0.2mol电子 |
| C、25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| D、0.1 L 浓度为3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com