
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30% H2O2) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
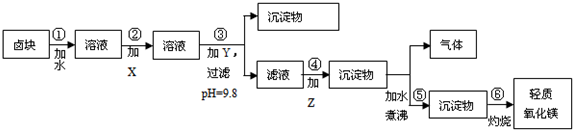
分析 为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO.
(1)依据图表数据和经济效益分析加入的试剂X的最佳选择;次氯酸钠具有氧化性在酸溶液中氧化 亚铁离子为铁离子,据此写出反应的离子方程式;
(2)步骤③的目的在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去;
(3)燃料电池中,正极发生的反应一定是氧气得电子的过程;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳;
(4)在步骤⑤中发生的反应是碳酸镁加热和水反应生成氢氧化镁沉淀,氢氧化镁沉淀溶解度小于碳酸镁的溶解度实现沉淀转化.
解答 解:(1)步骤②是为了将Fe2+氧化成Fe3+,并在控制合适的pH条件时生成Fe(OH)3沉淀而除之,虽然漂液和H2O2都可采用,但对比表2提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理,流程中加入次氯酸钠在酸性溶液中会氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:漂液NaClO;2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(2)步骤③的目的在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,应加入NaOH,如加入纯碱,不能达到较高的PH,分析表1提供的数据:除去杂质离子合理的pH范围是3.7<pH<9.8,在此范围内,如果pH过高,就会有大量的Mg2+生成Mg(OH)2而进入沉淀中,从而导致生产成本的提高;为了兼顾产品质量和生产成本,选择pH=9.8最合理,当然此时Mg2+也会部分生成Mg(OH)2沉淀,但由于卤块价格低廉,这点不可避免的损失还是可以承受的,以此保证产品的纯度,
故答案为:烧碱;使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;
(3)该电池中,正极反应一定是氧气得电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-),
故答案为:O2+4e-+2CO2═2CO32-;
(4)在步骤⑤中发生的反应是碳酸镁加热和水反应生成氢氧化镁沉淀,氢氧化镁沉淀溶解度小于碳酸镁的溶解度实现沉淀转化,反应的化学方程式为:MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+CO2↑,
故答案为:MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+CO2↑.
点评 本题通过以卤块为原料制取轻质氧化镁的工艺流程,考查了物质制备实验方案的设计,题目难度中等,注意掌握化学基本实验操作方法,明确物质制备实验方案设计原则,本题中合理分析制取流程、得出氧化镁的制备原理为解题的关键,试题综合性较强、涉及知识点较多,充分考查了学生的分析、理解能力及化学实验能力.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 向水中加入少量NH4Cl固体,水的电离程度增大 | |
| B. | 向水中投入金属钾,水的电离平衡向右移动 | |
| C. | 向水中加入浓氨水,c(OH-)增大 | |
| D. | 保持温度不变,向水中加入少量NaOH固体,Kw增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 | / | 33~36 | / | 易溶于甲醇、乙醚,微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 煤和水煤气均是二次能源 | |
| B. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| C. | ①是将煤在空气中加强热使其分解的过程 | |
| D. | B为甲醇或乙酸时,原子利用率均达到100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com