
| A. | 加入NaOH固体 | B. | 加入CaCO3 固体 | C. | 加入食盐固体 | D. | 加入Na2SO3固体 |
分析 溶液中存在平衡:Cl2+H2O?H++Cl-+HClO,增大氯水中的HClO浓度,应改变条件是平衡向正反应方向移动,但不能加水稀释、不能加入与HClO反应的物质,据此结合平衡移动原理解答.
解答 解:A.加入NaOH固体,NaOH与HClO反应生成次氯酸钠,溶液中HClO浓度减小,故A不符合;
B.加入CaCO3固体,与氢离子反应,导致溶液中氢离子浓度降低,平衡向右移动,溶液中HClO浓度增大,故B符合;
C.加入食盐固体,溶液中氯离子浓度增大,平衡向左移动,溶液中HClO浓度减小,故C不符合;
D.亚硫酸钠具有还原性,加入亚硫酸钠固体,与氯气反应,溶液中氯气浓度减小、氢离子浓度增大,平衡向左移动,溶液中HClO浓度减小,故D不符合;
故选B.
点评 本题考查影响化学平衡的因素,难度不大,注意D选项中氯气反应的影响是主要因素.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
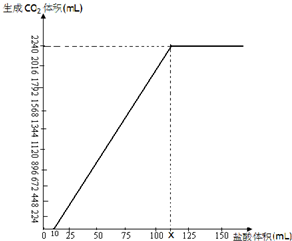 NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O→Na2CO3•nH2O(n为平均值,n≤10).取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如右图.(已知盐酸滴加至10mL时,开始产生气体,加至15mL时生成CO2112mL,溶解的CO2忽然不计)
NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O→Na2CO3•nH2O(n为平均值,n≤10).取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如右图.(已知盐酸滴加至10mL时,开始产生气体,加至15mL时生成CO2112mL,溶解的CO2忽然不计)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
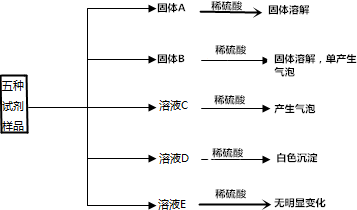 有5瓶白色固体试剂,分别是BaCl2、NaOH、Mg(OH)2、Na2CO3、BaCO3.现分别取少量试剂进行下列实验.请回答下列问题:
有5瓶白色固体试剂,分别是BaCl2、NaOH、Mg(OH)2、Na2CO3、BaCO3.现分别取少量试剂进行下列实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电器着火,立即浇水灭火 | |
| B. | 酒精灯碰翻着火,立即用湿抹布扑灭 | |
| C. | 汞滴洒落在地面上,立即撒上一层硫粉 | |
| D. | 皮肤沾上浓H2SO4,先用棉布吸去酸液,后立即用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据钠和镁分别与冷水的反应情况,判断钠和镁金属性的强弱 | |
| B. | 根据氯水与溴化钠溶液的反应情况,判断氯和溴非金属性的强弱 | |
| C. | 根据HF和HCl的水溶液的酸性强弱,判断氟与氯非金属的强弱 | |
| D. | 根据Na+和K+的氧化性的强弱,判断钠和钾的金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
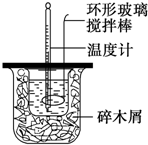 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com