
高温下,某反应达平衡,平衡常数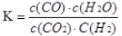 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2O
CO2+H2O
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.3盐类水解的应用试卷(解析版) 题型:填空题
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为 。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是 ,其原因是 。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是 ;②若为弱酸强碱盐,其水解的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2.3 酸碱中和滴定(解析版) 题型:选择题
某学生用碱式滴定管量取0.1 mol·L-1的NaOH溶液,开始时仰视液面读数为1.00 mL,取出部分溶液后,俯视液面,读数为11.00 mL,该同学在操作中实际取出的液体体积为( )
A.大于10.00 mLB.小于10.00 mL
C.等于10.00 mLD.等于11.00 mL
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷(解析版) 题型:选择题
一元弱酸HA(aq)中存在下列电离平衡:HA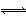 A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
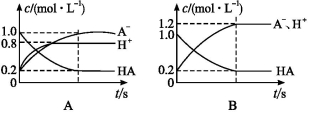
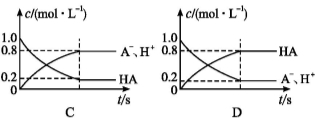
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷(解析版) 题型:选择题
下列关于强、弱电解质的叙述中正确的是( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离
D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(解析版) 题型:填空题
已知H+(aq)+OH-(aq) H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。
H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出 kJ的热量。
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热的ΔH= 。
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量 (填“大于”“小于”或“等于”)原来(1)放出的热量。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(解析版) 题型:选择题
测定稀盐酸和氢氧化钠稀溶液中和热的实验中没有使用的仪器有:①大、小烧杯;②容量瓶;③量筒;④环形玻璃搅拌棒;⑤试管;⑥温度计;⑦蒸发皿;⑧托盘天平中的( )
A.①②⑥⑦B.②⑤⑦⑧ C.②③⑦⑧D.③④⑤⑦
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学镁、铝及其化合物主要性质(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.稀硫酸与铁反应:2Fe+6H+=2Fe3++3H2↑
B.2 mol·L-1的AlCl3溶液和7 mol·L-1的NaOH溶液等体积均匀混合:
2Al3++7OH-=Al(OH)3↓+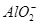 +2H2O
+2H2O
C.Ba(OH)2溶液中加入少量的NaHSO4溶液:
Ba2++2OH-+2H++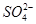 =BaSO4↓+2H2O
=BaSO4↓+2H2O
D.NaHCO3的水【解析】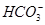 +H2O
+H2O 
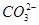 +H3O+
+H3O+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com