
����Ŀ��ʳ���еĿ�����������軯�أ��仯ѧʽΪK4[Fe(CN)6]��3H2O���Իش��������⣺
(1)��������֪����Ȼ�����軯���������Ժܵͣ�����ˮ��Һ���ᷴӦ�ų��������軯��(HCN)���壻�����軯�ؼ�����һ���¶�ʱ�ֽܷ�����軯��(KCN)���ݴ��жϣ����ʳƷʱӦע�������Ϊ______________��
(2)��25 ��ʱ����a mol��L��1��KCN��Һ��0.01 mol��L��1������������ϣ���Ӧ�ﵽƽ��ʱ�������ҺpH��7����KCN��Һ�����ʵ���Ũ��a________0.01 mol��L��1(������������������������)���ú�a�Ĵ���ʽ��ʾHCN�ĵ��볣��Ka��____________��
(3)��Fe2����Fe3���Ĵ������£���ʵ��2SO2��O2��2H2O=2H2SO4��ת������֪����SO2�ķ���ͨ�뺬Fe2����Fe3������Һ��ʱ������һ����Ӧ�����ӷ���ʽΪ4Fe2����O2��4H��=4Fe3����2H2O������һ����Ӧ�����ӷ���ʽΪ____________������ת������Ҫ��������______________��
(4)��֪Fe(OH)3���ܶȻ�����Ksp��1.1��10��36������ʱ��FeCl3��Һ�еμ�NaOH��Һ������ҺpHΪ3ʱ��ͨ������˵��Fe3���Ƿ������ȫ________ (��ʾ����ij����Ũ��С��10��5 mol��L��1ʱ������Ϊ�����ӳ�����ȫ)
���𰸡����������������һ�������������¶Ȳ�Ҫ̫�� �� ��100a-1����10-7 molL-1 2Fe3����SO2��2H2O=2Fe2����SO42-��4H�� ���Ϊ����������Ⱦ c(Fe3��)��![]() ��1.1��10��3 mol��L��1��1��10��5 mol��L��1����Fe3��û�г�����ȫ
��1.1��10��3 mol��L��1��1��10��5 mol��L��1����Fe3��û�г�����ȫ
��������
(1)���ᷴӦ�ų��������軯��(HCN)���壬�����軯�ؼ�����һ���¶�ʱ�ֽܷ�����軯��(KCN)��
(2)���ǵ�Ũ�ȣ���Ӧ������HCN����Һ��ʾ���ԣ��ٸ��ݵ��볣����ʽ���HCN�ĵ��볣����
(3)�������ص㣬�ָ�ԭ��״̬��Fe3+��Fe2+�����Խ���SO2����Ⱦ��ͬʱ�Ƶ����
(4)��Һ��c(H+)=10-3mol/L����c(OH-)=10-11mol/L ������Ksp=1.1��10-36=[c(OH-)]3��c(Fe3+)���㡣
(1)���������ᷴӦ�ų��������軯��(HCN)���������ٽ�ϼ�����һ���¶�ʱ�ֽܷ�����軯�أ���Ӧ������ס�����������������һ�������������¶Ȳ�Ҫ���ߣ�
(2)KCN+HCl�TKCl+HCN�����ǵ�Ũ�ȣ�����HCNӦ�ó����ԣ�����Ӧ��PH=7�����ԣ�˵��KCN��ʣ��(KCNˮ��ʼ���)������a��0.01mol/L��HCN![]() H++CN-��Ka=
H++CN-��Ka=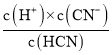 ����Һ��������c(H+)=10-7mol/L��c(CN-)=
����Һ��������c(H+)=10-7mol/L��c(CN-)=![]() mol/L(�������ϣ�ԭŨ�ȶ�����)c(HCN)=
mol/L(�������ϣ�ԭŨ�ȶ�����)c(HCN)=![]() mol/L�����빫ʽ��Ka=
mol/L�����빫ʽ��Ka=![]() =
=![]() =(100a-1)��10-7 molL-1��
=(100a-1)��10-7 molL-1��
(3)���ݴ������ص㣬��һ����Ӧһ����Fe3+��Fe2+����Ӧ����ʽΪ 2Fe3++SO2+2H2 �T2Fe2++SO42-+4H+��ͨ����Ӧ�������˴�����Ⱦ��SO2��ͬʱ�Ƶ������
(4)��ҺpHΪ3ʱ����Һ��c(H+)=10-3 mol/L����c(OH-)=10-11 mol/L ��Ksp=1.1��10-36=[c(OH-)]3��c(Fe3+)��c(Fe3+)=![]() =1.1��10-3(mol/L)��10-5 molL-1����Fe3��û�г�����ȫ��
=1.1��10-3(mol/L)��10-5 molL-1����Fe3��û�г�����ȫ��


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĸ���ͬ�������У��ڲ�ͬ���¶���(����������ͬ)���кϳɰ��ķ�Ӧ��������������ͬʱ���ڲ�õĽ���жϣ��÷�Ӧ�������¶���ߵ���( ����)
A.v(NH3)=0.1 mol /(Lmin)B.v(H2)=0.6 mol /(Lmin)
C.v(N2)=0.005 mol /(Ls)D.v(H2)=0.3 mol /(Lmin)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������������ ����֬ �������� ����ά�����������������У�����ˮ�����______������ţ����������в���ֱ�ӱ��������յ���________������ţ���������ˮ�����������__________�������ƣ�����֬ˮ���õ����Ľṹ��ʽ��_________��
��2��ijѧ�����������ʵ�鷽�����Լ������ˮ��������

��ˮ��Һ�ֱ��������ʵ�������ɵó���ʵ�����Ӧ����________������ţ���
A���������в���δˮ��
B����������ȫˮ��
C������û��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���CO2ͨ��2LpH=12��KOH��Һ�У���Һ��ˮ�����OH-����Ũ��(��)��ͨ���CO2�����(V)�Ĺ�ϵ����ͼ��ʾ��������������ȷ����
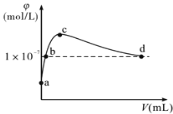
A��a����Һ�У�ˮ�������c(H+)=1��10-12mol/L
B��b����Һ�У�c(H+)=1��10-7mol/L
C��c����Һ�У�c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D��d����Һ�У�c(K+)=2c(CO32-)+c(HCO3-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һԪ��HA����Һ��KOH��Һ�������ϣ���������仯����ʵ���������±��������ж���ȷ���ǣ�������
ʵ���� | ��ʼŨ��/��mol��L��1�� | ��Ӧ����Һ��pH | |
c��HA�� | c(KOH) | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
A.ʵ��ٷ�Ӧ�����Һ�У�c��A������c��K+����c��OH������c��H+��
B.ʵ��ٷ�Ӧ�����Һ�У�c��OH����=c��K+����c��A����=![]() mol/L
mol/L
C.ʵ��ڷ�Ӧ�����Һ�У�c��A����+c��HA����0.1 mol/L
D.ʵ��ڷ�Ӧ�����Һ�У�c��K+��+c��OH����=c��H+��+c��A����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������һ����Ҫ�Ļ���ԭ�ϣ�һ���ɸ������Ʊ������������Ҫ�ɷ�ΪFeO��Cr2O3�������й衢�������ʡ��Ʊ�������ͼ��ʾ��

�ش��������⣺
��1������ٵ���Ҫ��ӦΪ��FeO��Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
������Ӧ��ƽ��FeO��Cr2O3��NaNO3��ϵ����Ϊ__________���ò��費��ʹ���մ�������ԭ����________________��
��2������1�к������Ľ���Ԫ����____________������2����Ҫ�ɷ���_____________���������ʡ�
��3������ܵ���Һ2��pHʹ֮��____________�����С������ԭ����___________________�������ӷ���ʽ��ʾ����
��4���й����ʵ��ܽ����ͼ��ʾ������Һ3���м�������KCl������Ũ������ȴ�ᾧ�����˵õ�K2Cr2O7���塣��ȴ��___________�����ţ��õ���K2Cr2O7�����Ʒ��ࡣ

a��80�� b��60�� c��40�� d��10��
����ݵķ�Ӧ������___________________��
��5��ij������m1 kg ������ۣ���Cr2O3 40%���Ʊ�K2Cr2O7�����յõ���Ʒ m2 kg������Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����NO�����ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�
2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�

A. �¶�T�£��÷�Ӧ��ƽ�ⳣ��K=![]()
B. �¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C. ����b��Ӧ�������ı�����Ǽ����˴���
D. ������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͷ���ؾ��������Ŀ������ã���ϳ�·����ͼ��ʾ��

��֪��
��RCH2Br![]() RCH=CHR��
RCH=CHR��
��2RCH=CHR��![]()
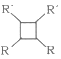
������R��R�������⡢�����
(1)��ͷ���صķ���ʽΪ____��
(2)�Լ�aΪ______��E��F�ķ�Ӧ����Ϊ________��
(3)F�Ľṹ��ʽΪ_________��
(4)C�к��еĹ���������Ϊ________��
(5) A��B��Ӧ�Ļ�ѧ����ʽΪ_________��
(6)F�����������ӳɵõ�G��G�ж���ͬ���칹�壬����������״��������____�֡�
(7)����ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�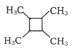 ��·��Ϊ____���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
��·��Ϊ____���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ȼ��������Ⱦ�Խ����������磬�����˾ӻ���������Ҫ���塣
I����NH3����ԭNOx�������������������Ⱦ��NOx����NOΪ�����ں��������н��з�Ӧ��4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ��H<0��
5N2(g)+6H2O(g) ��H<0��
��1������ѡ������жϷ�Ӧ�ﵽƽ��״̬����_______��
A��.4v��(NH3)=5v��(N2) B����Ӧ��ϵ�������ܶȲ���
C��.��Ӧ��ϵ������ѹǿ���� D����Ӧ��ϵ������ƽ��Ħ����������
��2��ͼI�����߱�ʾת�����뷴Ӧʱ��Ĺ�ϵ�����ı���ʼ������ʹ��Ӧ������a״̬תΪb״̬���У��ɲ�ȡ�Ĵ�ʩ��_______

A�������¶� B������Ӧ����NO��Ũ��
C���Ӵ��� D�����ܱ�������ͨ�����
II��ȼú�����к��д���SO2��NO��ij����С���о����������ļ����շ�ͬʱ�ѳ�SO2��NO���գ���Ӧ������ͼII��ʾ��
��Ӧ1��NO(g)��O3(g)![]() NO2(g)��O2(g)
NO2(g)��O2(g)
��Ӧ2��SO2(g)��O3(g)![]() SO3(g)��O2(g)
SO3(g)��O2(g)
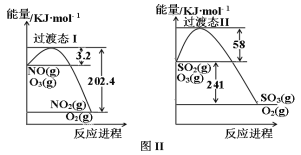
��֪����ϵ���¶�80�����ϳ��������ֽⷴӦ��2O3![]() 3O2����100��ʱ�����ķֽ���ԼΪ10������ش�
3O2����100��ʱ�����ķֽ���ԼΪ10������ش�
��1��д����Ӧ1���Ȼ�ѧ����ʽ_______����Ӧ1�ڸ����²����Է����У���÷�Ӧ���ر���S_______0����������������С��������
��2�������������䣬���������̶�Ϊ1L���ܱ������о����뺬1.0 mol NO��1.0 mol SO2��ģ��������2.0mol O3���ڲ�ͬ�¶��·�Ӧ��ͬʱ�����ϵ��NO��SO2��ת������ͼ��ʾ��
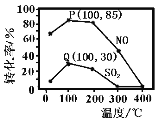
����P��Q����Ϊ��ƽ��㣬�Է���P��ת���ʴ���Q��Ŀ���ԭ��_______��100�棬t��ʱ��Ӧ1���е�P�㣬��Ӧ�ӿ�ʼ��t��ʱNO��ƽ������v(NO)=_______mol��L1��s1���ú�t��ʽ�ӱ�ʾ����
����Q��Ϊƽ��㣬100���·�Ӧ2��ƽ�ⳣ������ֵԼΪ_______����ȷ��0.01����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com