
【题目】硅是制作光伏电池的关键材料。在Si晶体中掺杂不同种类的元素,可形成多电子的n型或缺电子的p型半导体。n型和p型半导体相互叠加形成p-n结,此时自由电子发生扩散运动,在交界面处形成电场。下列说法正确的是
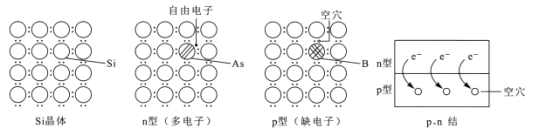
A.1molSi晶体中含有的Si-Si键数目为4NA
B.若在Si晶体中掺入P元素,可得n型半导体
C.p-n结中,n型一侧带负电,p型一侧带正电
D.光伏电池的能量转化形式为:光能→化学能→电能
科目:高中化学 来源: 题型:
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
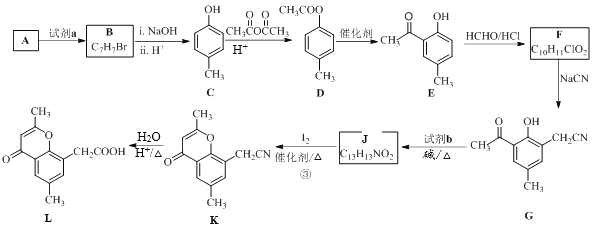 已知部分有机化合物转化的反应式如下:
已知部分有机化合物转化的反应式如下:
i.R-X![]() R-CN
R-CN![]() R-COOH(R为烃基)
R-COOH(R为烃基)
ii.RCHO+CH3COR′![]() RCH=CHCOR′(R、R′代表烃基或氢)
RCH=CHCOR′(R、R′代表烃基或氢)
iii.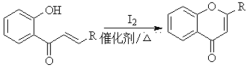 (R代表烃基或氢)
(R代表烃基或氢)
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)试剂a是_______________。
(3)C→D的化学方程式是___________________。
(4)F的结构简式是__________;试剂b是___________。
(5)J与I2反应生成K和HI的化学方程式是____________。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线_______________。
),参照下列模板写出相应的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设N为阿伏加德罗常数的值。下列说法正确的是( )
A.密闭容器中![]() 和
和![]() 催化反应后原子总数小于
催化反应后原子总数小于![]()
B.![]() 的浓盐酸与足量
的浓盐酸与足量![]() 共热,电子转移的数目为
共热,电子转移的数目为![]()
C.向![]() 溶液中滴加氨水至溶液呈中性混合液中
溶液中滴加氨水至溶液呈中性混合液中![]() 的数目为
的数目为![]()
D.在标准状况下,![]() 二氯乙烷(
二氯乙烷(![]() )中含有极性键的数目为
)中含有极性键的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】照相底片定影时,常用定影液硫代硫酸钠(![]() )溶解未曝光的溴化银(
)溶解未曝光的溴化银(![]() ),生成含
),生成含![]() 的废定影液再向其中加入
的废定影液再向其中加入![]() 使
使![]() 中的银转化为
中的银转化为![]() ,使定影液再生。将
,使定影液再生。将![]() 在高温下转化为Ag,达到回收银的目的。回答下列问题:
在高温下转化为Ag,达到回收银的目的。回答下列问题:
(1)元素周期表中,铜、银、金位于同一副族相邻周期,则基态银原子的最外层电子排布式为__________________。
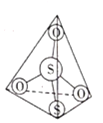
(2)![]() 离子结构如图所示,其中心硫原子的杂化方式为___________。基态S原子中,核外电子占据的最高能级的符号是__________,占据最高能级电子的电子云轮廓图为________形。
离子结构如图所示,其中心硫原子的杂化方式为___________。基态S原子中,核外电子占据的最高能级的符号是__________,占据最高能级电子的电子云轮廓图为________形。
(3)写出![]() 溶于
溶于![]() 溶液反应的离子方程式______。
溶液反应的离子方程式______。![]() 中存在的作用力有离子键、共价键、__________。
中存在的作用力有离子键、共价键、__________。
(4)在空气中灼烧![]() 生成
生成![]() 和
和![]() ,
,![]() 分子的空间构型为__________。分子中的大
分子的空间构型为__________。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数n代表参与形成大
键的原子数n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则
),则![]() 中的大
中的大![]() 键应表示为_________。
键应表示为_________。
(5)![]() 的键角小于
的键角小于![]() 的键角,原因是_________________。
的键角,原因是_________________。
(6)用X射线衍射法可测定阿伏加德罗常数。由金的X射线衍射图像可知金的晶胞属于面心立方晶胞。若金原子的半径为![]() ,金的密度为
,金的密度为![]() ,摩尔质量为
,摩尔质量为![]() ,列出计算阿伏加德罗常数的算式_________(用含
,列出计算阿伏加德罗常数的算式_________(用含![]() 的表达式表示)。
的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.0%)中回收金属Pd的工艺:
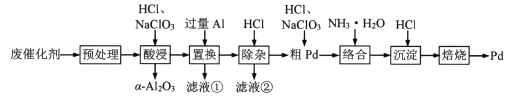
已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是_________。
(2)“酸浸”时,Pd转化为PdCl42-,其离子方程式为_________。
(3)“滤液①”和“滤液②”中都含有的主要溶质有_________(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是_________。两者相比,_________(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为_________。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的_________极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成_________填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物有着广泛的应用前景。回答下列问题:
(1)基态Co原子的核外电子排布式为_________.
(2)以无水乙醇作溶剂,Co(NO3)2可与某多齿配体结合形成具有催化活性的配合物,其结构简式如图所示。
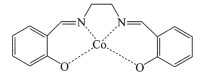
①配合物中提供孤对电子的原子是_________(填元素符号);
②该多齿配体中所含元素电负性由大到小的顺序为__________(填元素符号):
③下列化合物与上述配合物中C和N原子的杂化类型均相同的是__________(填标号)。
A.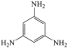 B.
B. C.
C. D.
D.
(3)亚硝酸钴钠可与K+结合形成K2Na[Co(NO2)6],从而实现对K+的定量测定。
①K2Na[Co(NO2)6]中存在的化学键类型有_________(填标号);
A.金属键 B.离子键 C.极性共价键 D.配位键
②与亚硝酸根互为等电子体的化合物有_________(写一种)。
(4)Co与Ca属于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高,原因是____。
(5)某种铁酸钴(CoTiO3)晶胞沿x、y或z轴任意一个方向的投影如下图所示。晶胞中Co处于各顶角位置,则O处于_________位置,与Co紧邻的O的个数为_________。若晶胞中Co与O的距离为anm,阿伏加德罗常数的值为NA,该晶体的密度为_________g.cm-3(列出计算式)。
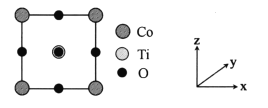
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物B是芳香烃的含氧衍生物,其相对分子质量不超过120,B中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应A+H2O![]() B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:

已知:![]()
根据以上信息,回答下列问题:
(1)B的结构简式为___________________________,条件I、II中均需要的试剂为___________________。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有_______个。
(3)C的同分异构体中,同时符合下列要求的物质有__________种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出下列转化的化学方程式
F→E_________________________________;
F→G_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
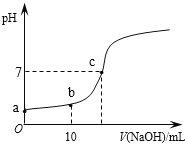
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:①2A(g)![]() 2B(g)+C(g);②A(g)
2B(g)+C(g);②A(g)![]() C(g)+D(g),当达到平衡时,测得c(A)= 2.5 mol/L,c(C)=2.0 mol/L.,则下列说法中正确的是
C(g)+D(g),当达到平衡时,测得c(A)= 2.5 mol/L,c(C)=2.0 mol/L.,则下列说法中正确的是
A.达到平衡时A的总转化率为40%
B.达到平衡时c(B)为1.0 mol/L
C.达到平衡时c(B)=2c(D)
D.达到平衡时c(D)=2c(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com