
【题目】常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
【答案】D
【解析】
A. 点①是10 mL 0.100 0 mol·L-1 NaOH溶液与20.00 mL 0.100 0 mol·L-1 CH3COOH反应后的溶液,溶质是等浓度的CH3COONa、CH3COOH的混合液;
B、点②溶液呈中性,根据电荷守恒分析;
C、 点③是20 mL 0.100 0 mol·L-1 NaOH溶液与20.00 mL 0.100 0 mol·L-1 CH3COOH反应后的溶液,溶质是CH3COONa溶液;
D.加入的NaOH比较少,形成CH3COONa、CH3COOH混合溶液时可能存在。
A. 点①是等浓度的CH3COONa、CH3COOH的混合液,根据质子守恒c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),故A错误;
B、根据电荷守恒,c(CH3COO-)+c(OH-)= c(Na+)+c(H+),点②溶液呈中性c(OH-)= c(H+),所以c(Na+)= c(CH3COO-),故B错误;
C、 点③是20 mL 0.100 0 mol·L-1 NaOH溶液与20.00 mL 0.100 0 mol·L-1 CH3COOH反应后的溶液,溶质是CH3COONa溶液,水解呈碱性,c(Na+) >c(CH3COO-)>c(OH-)>c(H+),故C错误;
D、加入的NaOH比较少,形成CH3COONa、CH3COOH混合溶液时可能存在c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正确。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
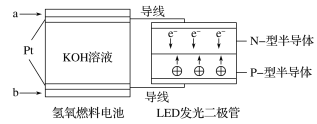
A.a处通入氧气,b处通入氢气
B.通入H2的电极发生反应:H2-2e-=2H+
C.通入O2的电极为电池的正极
D.该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 对2HI(g)![]() H2(g)+I2(g),增大压强可使平衡体系颜色变深
H2(g)+I2(g),增大压强可使平衡体系颜色变深
C. 反应CO+NO2![]() CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
D. 合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是

A. 直线b、d分别对应H+、OH-
B. pH=6时,c(HAc)>c(Ac-)>c(H+)
C. HAc电离常数的数量级为10-5
D. 从曲线a与c的交点可知pKa=pH=4.74
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中氧化剂是_____________________________。
(2)火箭残骸中常出现红棕色气体,原因为:N2O4(g) ![]() 2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是____________。

若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ________mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如下:
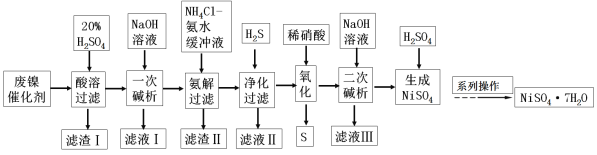
已知:① NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2小时,该操作的目的为_____。
(2)“滤渣I”主要成分在工业上的用途为___(只写1种即可),NH4Cl的电子式为_____。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为____。
(4)“氨解”的目的为________, “净化”时加入的H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为:________。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于____。(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)工业上利用电解法处理含氯化镍的酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是________。
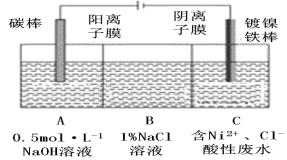
已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A.碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对有机物 说法正确的是
说法正确的是
A. 1mol该物质所含原子数为![]()
B. 该物质系统命名为2,3-二甲基-5-乙基己烷
C. 该物质一个分子中最多10个碳原子共平面
D. 该物质为某炔烃加氢后的产物,则可能的炔烃的结构只有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com