
【题目】下列叙述中一定正确的是
A.0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为10﹣13 mol/L
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10
C.仅含有Na+、H+、OH﹣、CH3COO﹣四种离子的某溶液中可能存在:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.1.0 molL﹣1Na2CO3溶液:c(OH﹣)=c(HCO3﹣)+c(H+)+2c(H2CO3)
【答案】BD
【解析】
A.0.1mol/L的CH3COOH溶液中c(H+)<0.1mol/L,则c(OH-)>10-13mol/L,所以由水电离出的c(H+)大于10-13mol/L,故A错误;
B.c(H+)=10-pH,所以pH=2与pH=1的CH3COOH溶液中c(H+)之比=10-2:10-1=1:10,故B正确;
C.溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)=c(CH3COO-)+c(OH-),如果c(Na+)>c(CH3COO-),则c(H+)<c(OH-),故C错误;
D.根据物料守恒得c(Na+)=2c(![]() )+2c(H2CO3)+2c(
)+2c(H2CO3)+2c(![]() ),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(
),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(![]() )+2c(
)+2c(![]() ),所以得c(OH-)=c(
),所以得c(OH-)=c(![]() )+c(H+)+2c(H2CO3),故D正确;
)+c(H+)+2c(H2CO3),故D正确;
故答案为:BD。


科目:高中化学 来源: 题型:
【题目】侯氏制碱法原理是:NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl析出碳酸氢钠,下列实验装置及原理设计说法不合理的是:
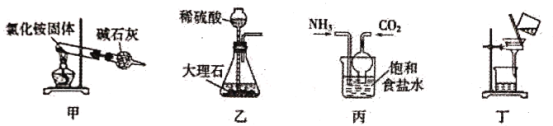
A.用装置甲制取氨气时得到氨气很少,主要原因是分解得到NH3、HCl的遇冷会重新化合
B.用装置乙生成的CO2速率很慢,原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面
C.用装置丙模拟侯氏制碱法,可以同时通入NH3、CO2,也可以先通氨气再通CO2
D.用装置丁分离得到产品NaHCO3,为得到干燥产品,也可采用减压过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2HI(g) ![]() H2(g) + I2(g) - 11 kJ,正确的是
H2(g) + I2(g) - 11 kJ,正确的是
A.反应物的总键能低于生成物的总键能
B.1mol I2(g)中通入1mol H2(g),反应放热11kJ
C.等物质的量时,I2(g)具有的能量低于I2(l)
D.平衡时分离出HI(g),正反应速率先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
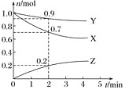
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__________________________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。

(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比为
A.8:1B.2:1C.3:2D.2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或化学用语的表述正确的是
A. 由水电离出的c(H+)=1.0×10-12 molL1的溶液中可能大量存在:Na+、K+、SO32-、HCO3-
B. 常温下,c(OH-)/c(H+)=1.0×1012的溶液中可能大量存在NH4+、Na+、Cl-、NO3-
C. 硫酸氢钠溶于水的电离方程式为:NaHSO4=Na++H++SO42-
D. 碳酸钠溶液呈碱性的原因:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一组电化学装置如图所示,其中乙装置中X为阳离子交换膜,甲醇(CH3OH)具有可燃性。

根据要求回答相关问题:
(1)写出装置甲中负极的电极反应式:___。
(2)装置乙中石墨电极(C)的电极反应式为:___。
(3)当装置甲中消耗0.05molO2时,丙装置中阳极产生气体的体积___L(标况下);
(4)装置乙中溶液的pH为___(溶液体积为200mL不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:甲、乙为相互串联的两电解池。试回答:
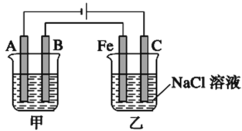
(1)乙池中Fe极电极反应式为___________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈_________色。
(2)甲池若为用电解原理精炼铜(假设粗铜的组成是均匀的,且比其活泼和不活泼的成分均存在)的装置,则A电极名称为_____极,电极反应式为____________,电解质溶液可以是______;通电一段时间后,A极增重12.8g,则甲池溶液原溶质的浓度______(填“增大”、“减小”、“不变”或“无法确定”),乙池C(石墨)极放出气体在标准状况下的体积为________,若此时,乙池剩余溶液为25℃,体积为400 mL,则溶液的pH=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com