
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。
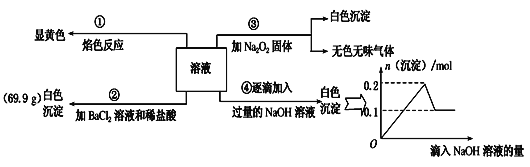
请回答下列问题:
(1)焰色反应是___(填“物理”或“化学”)变化;实验③中产生的无色无味气体是___(填化学式)。
(2)原溶液中一定存在的离子有___;一定不存在的离子有___。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=___mol/L。
【答案】物理 O2 Na+、Mg2+、Al3+、SO42- Fe3+、Cu2+、CO32-、NH4+ 0.6
【解析】
溶液为无色,说明不存在Fe3+和Cu2+,①经过焰色反应显黄色,说明存在Na+,②加入BaCl2和稀盐酸产生白色沉淀,说明一定存在SO42-,可能存在CO32-,③加入Na2O2固体,Na2O2与水反应生成NaOH和O2,无色无味的气体是O2,说明没有NH4+,产生白色沉淀,说明存在Mg2+、Al3+中的一种或两种,④逐滴加入NaOH溶液直至过量,沉淀的总物质的量先是增大到最大值,后又减少直至不变,说明一定存在Al3+和Mg2+,则不存在CO32-,据此分析解答。
(1)焰色反应中没有新物质生成,是物理变化;实验③中加入Na2O2固体,Na2O2与水反应生成NaOH和O2,无色无味的气体是O2,故答案为:物理;O2;
(2)根据以上分析可知,原溶液中一定存在的离子有:Na+、Mg2+、Al3+、SO42-,
一定不存在的离子有:Fe3+、Cu2+、CO32-、NH4+,而K+则无法判断,故答案为:Na+、Mg2+、Al3+、SO42-;Fe3+、Cu2+、CO32-、NH4+;
(3)第②步产生的是BaSO4沉淀,则n(SO42-)=![]() =0.3mol,第④步中,沉淀产生最大物质的量为0.2mol,说明n(Al3+)+n(Mg2+)=0.2mol,最后剩下0.1mol沉淀,说明n(Mg2+)=0.1mol,则n(Al3+)=0.1mol,根据溶液为电中性,则有2n(Mg2+)+3n(Al3+)+n(Na+)+n(K+)=2n(SO42-),即2×0.1mol+3×0.1mol+n(Na+)+1×0.04mol=2×0.3mol,所以c(Na+)=
=0.3mol,第④步中,沉淀产生最大物质的量为0.2mol,说明n(Al3+)+n(Mg2+)=0.2mol,最后剩下0.1mol沉淀,说明n(Mg2+)=0.1mol,则n(Al3+)=0.1mol,根据溶液为电中性,则有2n(Mg2+)+3n(Al3+)+n(Na+)+n(K+)=2n(SO42-),即2×0.1mol+3×0.1mol+n(Na+)+1×0.04mol=2×0.3mol,所以c(Na+)=![]() =0.6mol/L,故答案为:0.6。
=0.6mol/L,故答案为:0.6。


科目:高中化学 来源: 题型:
【题目】下列解释相关问题或实验的离子方程式不正确的是( )
A.NaClO溶液呈碱性:ClO-+H2O![]() HClO+OH-
HClO+OH-
B.向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
C.粗盐提纯中除去Mg2+:Mg2++2OH-=Mg(OH)2↓
D.工业上精炼粗铜的阴极反应:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2) 写出C元素基态原子的电子排布式_________________________。
(3)写出D元素原子的价电子排布图____________________。
(4) 元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化可得到有机物(CH3)2C=C(CH3)2(以下用A表示)。
(1)A的系统命名为________;A在通常状况下呈________(填“气”“液”或“固”)态。
(2)A与Br2的加成产物B与NaOH的乙醇溶液共热可生成二烯烃C,则C的结构简式为___________________;B生成C的反应类型为________。
(3)C与一定量Br2反应可能生成D、E和G,而D与HBr的加成产物只有F,则D形成高分子化合物的化学方程式为__________________________________________。
(4)C的同分异构体中不可能为________(填字母)
a.芳香烃 b.炔烃 c.环烯烃 d.二烯烃
若C的一种同分异构体H与KMnO4酸性溶液生成己二酸,则H的结构简式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示。
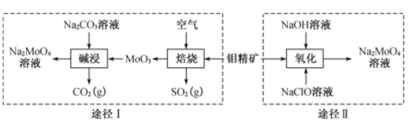
(1)NaClO的电子式为 ___。
(2)途径Ⅰ碱浸时发生反应的化学方程式为____。
(3)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为____。
(4)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是______[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(5)分析纯钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径Ⅰ所产生的气体一起通入水中,得到正盐的化学式是_______。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图
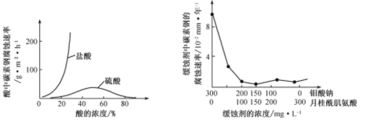
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是____。
②若缓蚀剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M =206g·mol-1) 的物质的量浓度为____(计算结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34g FeSO47H2O 样品在隔绝空气条件下受热脱水 过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是( )
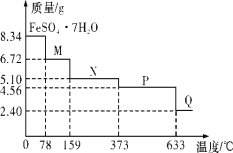
A.温度为 80℃时固体物质 M 的化学式为 FeSO45H2O
B.温度为 200℃时固体物质N 化学式为 FeSO43H2O
C.在隔绝空气条件下由N 到 P 的化学方程式为FeSO4![]() FeO+SO3↑
FeO+SO3↑
D.取 380℃ 时所得的样品 P,隔绝空气加热至 650℃, 得到的固体物质 Q 的化学式为 Fe2O3,同时有两种无色气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图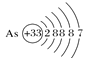 B.BF4—的结构式
B.BF4—的结构式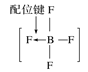
C.HF分子间的氢键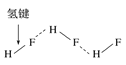 D.丙氨酸的手性异构
D.丙氨酸的手性异构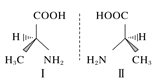
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com