
| A. | 常温下,0.1mol/LNa2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的①CH3 COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
分析 A.常温下,0.1mol/LNa2S溶液中存在质子守恒水电离出的氢离子所有存在形式浓度和氢氧根离子浓度相同;
B.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合得到碳酸钠溶液,碳酸根离子水解溶液显碱性;
C.对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
D.一水合氨溶液中存在电离平衡,加入硫酸铵溶解后铵根抑制电离平衡逆向进行.
解答 解:A.常温下,0.1mol/LNa2S溶液中硫离子水解显碱性,溶液中存在质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合得到碳酸钠溶液,碳酸根离子水解溶液显碱性,溶液中离子浓度大小为C(Na+)>c(CO32-)>c(OH-)>c(HCO3- )>c(H+),故B错误;
C.在相同的条件下测得①NaHCO3 ②CH3COONa ③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即c(Na+)①>②>③,故C正确;
D.向0.1mol•L-1的氨水中存在电离平衡,NH3•H2O?NH4++OH-,加入少量硫酸铵固体抑制电离平衡逆向进行,氢氧根离子浓度减小,一水合氨浓度增大,比值减小,故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小、盐类水解分析应用、弱电解质电离平衡,注意反应产物的判断,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白、红、白 | B. | 红、黑、白 | C. | 红、红、红 | D. | 白、黑、白 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
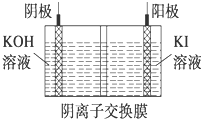 碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.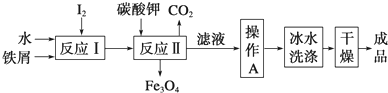
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
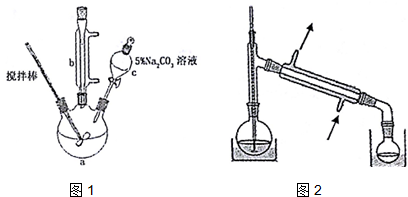
| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
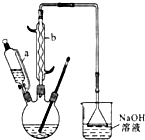 己二酸
己二酸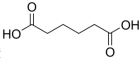 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下: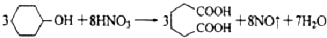
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
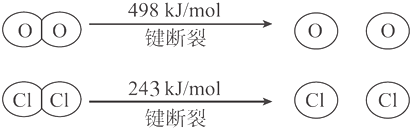
| A. | 12kJ | B. | 32kJ | C. | 115.6kJ | D. | 127.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
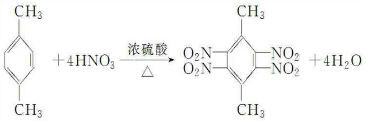 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
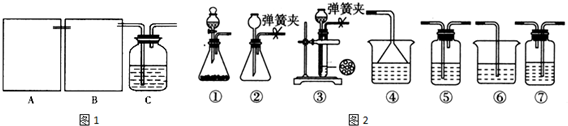
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com