
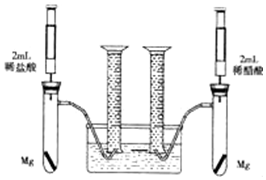
 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)分析 (1)镁与醋酸反应生成醋酸镁和氢气,离子方程式中醋酸需要保留分子式;
(2)两种酸的浓度必须相等,才能比较反应速率快慢;
(3)醋酸为弱酸,溶液中只能部分电离出氢离子,则醋酸与镁的在开始时反应速率较小;由于两种酸的物质的量相等,则生成氢气的最终体积相等;
(4)该反应放热,过量镁与水反应生成了氢气;
(5)盐酸醋酸氢气速率快、醋酸慢,说明盐酸的酸性较强;
(6)根据弱电解质的电离是不完全的,酸的溶解性及酸的通性无法确定酸电离的程度,而比较酸的浓度与酸电离c(H+)可判断酸的电离程度,证明醋酸是弱电解质的常用方法有:根据醋酸的电离程度、根据醋酸的强碱盐溶液的酸碱性判断;
(7)c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,根据Ksp计算pH;
解答 解:(1)醋酸与镁反应生成醋酸镁和氢气,反应的离子方程式为:Mg+2CH3COOH═Mg2++2CH3COO-+H2↑,
故答案为:Mg+2CH3COOH═Mg2++2CH3COO-+H2↑;
(2)根据产生氢气的速率判断酸性强弱时,必须指出醋酸和盐酸的浓度相等,否则无法比较,所以欠缺为:没有说明两种酸的物质的量浓度相等,
故答案为:没有说明两种酸的物质的量浓度相等;
(3)醋酸为弱酸,盐酸为强酸,浓度相等时醋酸中氢离子浓度小于盐酸,则与镁的反应中,盐酸的快,醋酸的慢;由于醋酸和盐酸的浓度、体积相等,镁过量,则最终生成氢气的体积相等,
故答案为:>;=;
(4)镁在加热条件下能够与水反应,所以该反应放热,导致过量镁与水反应生成氢气,所以产生的氢气比理论值高,
故答案为:反应放热,过量镁与水反应;
(5)根据醋酸、盐酸与镁反应产生氢气的速率可知,盐酸中氢离子浓度大于醋酸,则盐酸酸性比醋酸强,
故答案为:盐酸酸性比醋酸强;
(6)①当温度低于16.6℃时醋酸可凝结成冰一样晶体,说明醋酸熔点低,不能证明其为弱酸,故①错误;
②0.1mol/L的醋酸钠溶液的pH值约为9,说明醋酸钠是强碱弱酸盐,故②正确;
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸是二元强酸,所以硫酸溶液消耗的氢氧化钠多,但不能说明醋酸是弱电解质,故③错误;
④0.1mol/L的醋酸的pH值约为4.8,说明醋酸部分电离,故④正确;
⑤pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多,说明醋酸部分电离,溶液中存在大量的醋酸分子,故⑤正确;
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水少,说明醋酸溶液中氢离子浓度较小,醋酸在溶液中部分电离,从而证明醋酸为弱酸,故⑥正确;
故答案为:①③;
(7)Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,c(0H-)=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$=10-9mol/L,c(H+)=10-5mol/L,所以pH=5,即生成Cu(OH)2沉淀,应调整溶液pH,使之大于5,故答案为:5.
点评 本题考查了酸性强弱比较的方法,题目难度中等,明确弱电解质的电离平衡及其影响因素为解答关键,注意掌握判断酸性强弱的方法,试题培养了学生的分析能力及化学实验能力.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液的阴极电极反应式:Mg2++2e-═Mg | |
| B. | 惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| C. | 醋酸与乙醇混合、浓硫酸催化加热:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 硫酸铝和小苏打溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
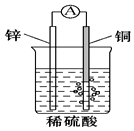
| A. | 构成原电池的两个电极必须是活泼性不同的两种金属 | |
| B. | 通过构成原电池,能将反应的化学能全部转化为电能 | |
| C. | 右图原电池中,电池工作时,SO42-移向电池的正极 | |
| D. | 银锌纽扣电池的放电反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| B. | 在空气中,光亮的银器表面逐渐变暗 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.5 mol•L-1的Fe2(SO4)3 溶液中Fe3+的数目为NA | |
| B. | 室温下,pH=13的NaOH溶液中,OH-离子数目为0.1NA | |
| C. | 0.1 L 0.5 mol•L-1 CH3COOH溶液中含有的氢离子数目小于0.05NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 可能含有SO32- | D. | 肯定不含SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
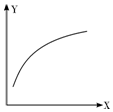 在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 减小压强 | A的转化率 |
| D | 升高温度 | 混合气体平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com