
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 | |
| B. | 任何离子键在形成的过程中必定有电子的得与失 | |
| C. | 在氯化钠中,氯离子和钠离子靠静电作用结合 | |
| D. | 金属钠与氯气反应生成氯化钠后,体系能量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
.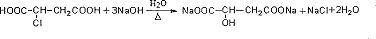 .
. 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: | |
| B. | Na2O2的电子式为: | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | 丙烯的结构式:CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、K+、SO${\;}_{4}^{2-}$、Br- | |
| B. | 含有硝酸钠的溶液:H+、Fe2+、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO${\;}_{2}^{-}$、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Na+、Ca2+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铊既能与强酸反应又能与强碱反应 | B. | 能生成+3价的化合物 | ||
| C. | Tl(OH)3与Al(OH)3一样是两性氢氧化物 | D. | Tl(OH)3的碱性比Al(OH)3强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com