
【题目】I.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
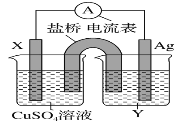
请回答下列问题:
(1)电极 X 的材料是__________填化学式);电解质溶液 Y 是______填化学式)。
(2)银电极发生______填“氧化”或“还原”)反应,其电极反应式为_________;X 电极反应式为_____。
II. 高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放 电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
请回答下列问题:
(1)已知放电时负极反应为 Zn-2e-+2OH- ===Zn(OH)2,则正极反应 为_____________。
(2)放电时,_____(填“正”或“负”)极附近溶液的 pH 升高。
(3)高铁电池充电时,电池的负极与电源的_____(填“正极”或“负极”),充 电时与电池负极相连的电极反应为__________。
III.近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和 水分子通过。其工作原理的示意图如下:
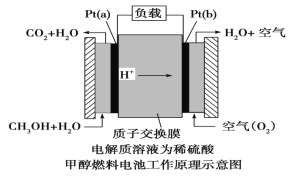
请回答下列问题: (1)该燃料电池的总反应为_________。
(2)Pt(a)电极是电池的_____(填“正”或“负”)极,电极反应式为:__________; Pt(b)电极反应式为___________。
【答案】Cu AgNO3 还原 Ag++e=Ag Cu-2e-=Cu2+ FeO42-+4H2O+3e- = Fe(OH)3+5OH- 正 负 Zn(OH)2+2e-= Zn+2OH- 2CH3OH+3O2=2CO2+4H2O 负 CH3OH+H2O-6e-═CO2+6H+ O2+4H++4e-═2H2O
【解析】
I. 由反应方程式可知,该原电池的电极反应式为:正极:2Ag++2e-═2Ag,负极:Cu-2e-═Cu2+,所以X极的材料应为Cu,电解质溶液Y应为AgNO3溶液,外电路中的电子从Cu极流向Ag极;
II. (1) 放电时,该电池是原电池,原电池正极上得电子化合价降低而发生还原反应;
(2)根据电极反应式确定pH 升高的电极。
(3)高铁电池充电时,为电解池,负极与电池的负极相连,为电解池的阴极,发生还原反应;
III. (1) 原电池反应的实质为氧化还原反应,甲醇被氧化生成二氧化碳和水;
(2) 该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,通入氧化剂的电极为正极,正极上得电子发生还原反应。
I. (1) 由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3溶液 ;
(2) 正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,发生还原反应,电极反应为Ag++e=Ag,X为负极,铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+;
II. (1) 放电时,该电池是原电池,负极反应为 Zn-2e-+2OH- =Zn(OH)2,则正极上发生还原反应,电极反应式为FeO42-+4H2O+3e- = Fe(OH)3+5OH-;
(2) 放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,生成氢氧根离子,碱性要增强,即正极附近溶液的 pH升高;
(3)高铁电池充电时为电解池,负极与电池的负极相连,为电解池的阴极,发生氧化反应,电极反应式为Zn(OH)2+2e-= Zn+2OH-;
III. (1) 原电池反应的实质为氧化还原反应,甲醇被氧化生成二氧化碳和水,电池总反应为2CH3OH+3O2=2CO2+4H2O;
(2) 该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,电解方程式为CH3OH+H2O-6e-═CO2+6H+,通入氧化剂的电极为正极,正极上得电子发生还原反应,电极方程式为O2+4H++4e-═2H2O。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 已知t1℃时,反应C+CO2![]() 2CO ΔH >0的速率为υ,若升高温度,逆反应速率减小
2CO ΔH >0的速率为υ,若升高温度,逆反应速率减小
B. 恒压容器中发生反应N2+O2![]() 2NO,若在容器中充入He,正逆反应速率均不变
2NO,若在容器中充入He,正逆反应速率均不变
C. 当一定量的锌粉和过量的6molL-1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入少量的CuSO4溶液
D. 对于工业合成氨反应N2+3H2![]() 2NH3,选用450℃主要为了提高催化剂(铁触媒)的催化效率
2NH3,选用450℃主要为了提高催化剂(铁触媒)的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:![]()
![]()
![]() 某温度下,在4L密闭容器中加入纳米级
某温度下,在4L密闭容器中加入纳米级![]() 并通入
并通入![]()
![]() ,记录不同时间产生
,记录不同时间产生![]() 的物质的量如表:
的物质的量如表:
时间 | 20 | 40 | 60 | 80 |
|
|
|
|
|
下列说法正确的是
A.前20min的反应速率![]()
B.达平衡时,至少需要从外界吸收的能量为![]()
C.增大![]() ,可以提高水的分解率
,可以提高水的分解率
D.使用纳米级![]() 颗粒是为了提高催化效果
颗粒是为了提高催化效果
查看答案和解析>>
科目:高中化学 来源: 题型:
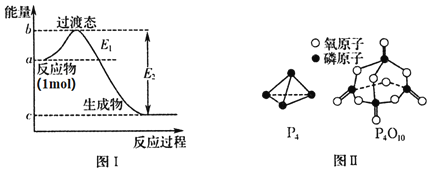
【题目】磷及其化合物在化工生产中有着广泛的应用,请对下列问题作答。
![]() 有多种单质,其中一种叫白磷,分子式为
有多种单质,其中一种叫白磷,分子式为![]() ,结构如图Ⅱ所示,
,结构如图Ⅱ所示,![]() 分子的活泼性比
分子的活泼性比![]() 分子______
分子______![]() 填强或弱
填强或弱![]() 。
。
![]() 白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设
白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设![]() 、
、![]() 、
、![]() 的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出
的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出![]() 的键能的表达式为______
的键能的表达式为______
![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
![]() 可用于化学镀镍。配平并完成下列化学方程式:
可用于化学镀镍。配平并完成下列化学方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
![]() 磷酸是一种三元中强酸,已知
磷酸是一种三元中强酸,已知![]() ,
,![]() ,
,![]() ,
,![]() 的水溶液显______性,解释原因______。
的水溶液显______性,解释原因______。
![]() 是重要的化工原料,某温度下,反应
是重要的化工原料,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,在1L的密闭容器中加入
,在1L的密闭容器中加入![]() ,平衡后
,平衡后![]() 的浓度是______。
的浓度是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=10 的 X、Y 两种碱溶液各 1 mL,分别稀释至 100 mL,其 pH 与溶液体 积(V)的关系如图所示,下列说法正确的是( )
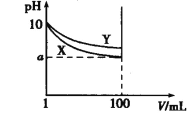
A.若 8<a<10,则 X、Y 都是弱碱
B.X、Y 两种碱溶液中溶质的物质的量浓度一定相等
C.稀释后,X 溶液的碱性比 Y 溶液的碱性强
D.分别完全中和 X、Y 这两种碱溶液时,消耗同浓度盐酸的体积 Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列各组离子一定能在指定环境中大量共存的是( )
A.在c(H+)=10-10 mol/L的溶液中 Al3+ 、NH![]() 、Cl- 、NO
、Cl- 、NO![]()
B.pH值为13的溶液 K+ 、SO![]() 、Na+、S2-
、Na+、S2-
C.水电离出来的c(H+)=10-12mol/L的溶液 K+、NH4+、Cl-、ClO-
D.甲基橙呈红色的溶液中 Fe3+、Na+ 、SO42-、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组针对反应![]() 进行研究。下列研究结论正确的是
进行研究。下列研究结论正确的是
A.若向绝热恒容密闭容器中通入一定量的![]() 和
和![]() 进行反应,正反应速率随时间变化的曲线如图Ⅰ所示,则A点反应达到平衡
进行反应,正反应速率随时间变化的曲线如图Ⅰ所示,则A点反应达到平衡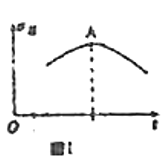
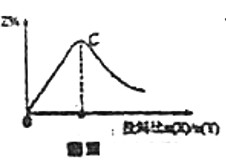
B.若恒温条件下进行反应,Y的平衡转化率![]() 与压强
与压强![]() 的关系如图Ⅱ所示,则B点
的关系如图Ⅱ所示,则B点![]()

C.若恒温恒容,改变X与Y的投料比![]() 进行反应,平衡时Z的百分含量
进行反应,平衡时Z的百分含量![]() 随
随![]() 变化的曲线如图Ⅲ,则C点
变化的曲线如图Ⅲ,则C点![]()
D.若恒容条件下投入一定量的X和Y边加热边进行反应,X的体积分数![]() 随温度的变化如图Ⅳ所示,则该反应反应物的总能量高于生成物的总能量
随温度的变化如图Ⅳ所示,则该反应反应物的总能量高于生成物的总能量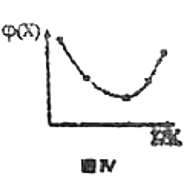
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
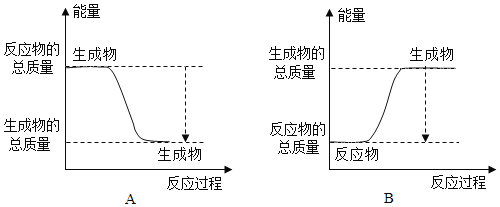
(1)已知一定条件下,反应![]() 为放热反应:
为放热反应:
①下图能正确表示该反应中能量变化的是______;
②根据下表数据,计算生成1mol![]() 时该反应放出的热量为______kJ;
时该反应放出的热量为______kJ;
化学键 |
|
|
|
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3mol![]() 和1mol
和1mol![]() 通入容积为2L的密闭容器中发生反应,5min达到平衡,测得
通入容积为2L的密闭容器中发生反应,5min达到平衡,测得![]() ,则0至5min时
,则0至5min时![]() ______,达到平衡时
______,达到平衡时![]() 的转化率为______。
的转化率为______。
(2)某兴趣小组为研究原电池原理,设计如图装置。
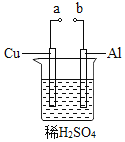
①![]() 和b用导线连接,Cu极为原电池______极
和b用导线连接,Cu极为原电池______极![]() 填“正”或“负”
填“正”或“负”![]() ,电极反应式是:______;
,电极反应式是:______;
Al极发生______![]() 填“氧化”或“还原”
填“氧化”或“还原”![]() 反应,其电极反应式为:______,溶液中
反应,其电极反应式为:______,溶液中![]() 移向______。
移向______。![]() 填“Cu”或“Al”极
填“Cu”或“Al”极![]() 溶液pH______
溶液pH______![]() 填增大或减小
填增大或减小![]() ;当负极金属溶解
;当负极金属溶解![]() 时,______
时,______![]() 电子通过导线。
电子通过导线。
②不将a、b连接,请问如何加快Al与稀硫酸的反应速率?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com