
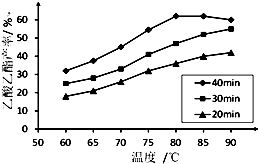
 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:| 浓硫酸 |
| △ |
| c(H+).c(CH3COO-) |
| c(CH3COOH) |
| c(H+).c(CH3COO-) |
| c(CH3COOH) |
| 0.10×1.3%×0.10×1.3% |
| 0.10 |
| c(CH3COOH) |
| c(CH3COONa) |
| 0.1 |
| c(CH3COONa) |


科目:高中化学 来源: 题型:
| A、向盐酸中滴加氨水:H++OH-=H2O |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2 NO↑+4H2O |
| D、CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验结论 |
| (1)将混合物溶于水,得到无色透明溶液 | 原混合物肯定无 |
| (2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 原混合物肯定有 |
| (3)在另一份溶液中加入NaOH溶液,也产生白色沉淀 | 原混合物肯定有 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).
甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).| 10min | 20min | 30min | 40min | 50min | 60min | ||
| 3000C | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 | |
| 5000C | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
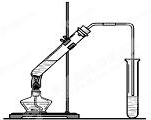 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、一定浓度的盐酸 | 饱和Na2CO3溶液 | 1.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com