
【题目】下列叙述正确的是( )
A.常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.溶液中c(H+)越大,pH也越大,溶液的酸性就越强
【答案】B
【解析】解:A.常温下,pH=3和pH=5的盐酸各10mL混合,混合溶液中c(H+)= ![]() mol/L,pH=﹣lgc(H+)=﹣lg
mol/L,pH=﹣lgc(H+)=﹣lg ![]() =﹣lg5.5×10﹣4<4,故A错误; B.离子积常数只与温度有关,温度不变离子积常数不变,故B正确;
=﹣lg5.5×10﹣4<4,故A错误; B.离子积常数只与温度有关,温度不变离子积常数不变,故B正确;
C.完全电离的电解质是强电解质,在水溶液中或或熔融状态下能导电的化合物是电解质,液氯是单质,既不是电解质也不是非电解质,故C错误;
D.溶液中c(H+)越大,溶液的pH越小,溶液的酸性越强,故D错误;
故选B.
A.常温下,pH=3和pH=5的盐酸各10mL混合,混合溶液中c(H+)= ![]() mol/L,pH=﹣lgc(H+);
mol/L,pH=﹣lgc(H+);
B.离子积常数只与温度有关;
C.完全电离的电解质是强电解质,在水溶液中或或熔融状态下能导电的化合物是电解质;
D.溶液中c(H+)越大,溶液的pH越小.


科目:高中化学 来源: 题型:
【题目】2010年上海世博会将实现环保世博、生态世博目标,下列做法中不符合这一目标的是( )
A.部分国家的展馆使用可降解的建筑材料
B.把世博会期间产生的垃圾焚烧或深埋处理
C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
D.停车场安装了催化光解设施,用于处理汽车尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶:“84消毒液”,包装说明如下:
净含量:1000 mL 密度:1.19 g·cm-3
主要成分:25%NaC1O
使用方法:稀释l00倍(体积比)后使用
注意亊项:密封保存,易吸收空气中的CO2变质
请根据以上信息和相关知识判断,下列分析不正确的是
A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”中含NaC1O的质量为297.5g
C. 取l00mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04 mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制25%NaClO的消毐液480 mL,需要称量的NaClO固体质量为I43g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如下图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HC1中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈浅蓝色浑浊:③丙处河水由浑变淸:④丁处产生气泡,河水仍淸,请推断:

(1)工厂棑除的废液里含有的污染物:甲_______,乙_____________。
(2)写出④中有关反应的离子方程式___________________。
(II)X、Y、Z三种物质有如下转化关系:

(1)根据上述转化关系,写出下列物质的化学式:X_______、试剂乙________________。
(2)写出③步反应的离子方程式:③___________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消細,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(1)方法一的离子方程式为______________________________。
(2)方法二中被氧化的物质是_______,若反应中有0.1 mol电子转移,则产生的ClO2气体在标准状况下的体积为_________L。
(3)用双线桥法标出方法一中方程式电子转移的方向和数目_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
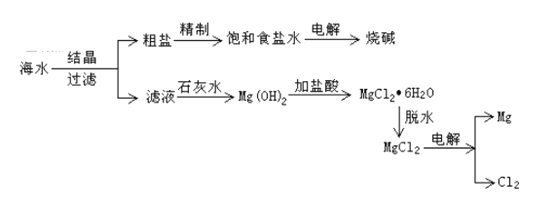
(1)过滤时所需要玻璃仪器为烧杯、漏斗和_________,补填的玻璃仪器在过滤时,起到了______________的作用。
(2)下图为电解食盐水的装置,石墨电极上产生的气体为_________;在铁棒周围的溶液里滴加酚酞溶液,溶液变________色。
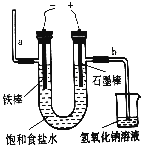
(3)写出电解饱和食盐水的化学方程式:____________________________。
(4)下表是某“加碘食盐”包装袋上的部分文字说明.
配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
含碘量 | 20~40 mg·kg-1 |
保质期 | 18个月 |
食用方法 | 勿长时间炖炒 |
贮藏指南 | 避热、避光、密封、防潮 |
①经测定,该“加碘食盐”中KIO3的含量为42.8 mg·kg-1。计算每千克“加碘食盐”中KIO3的物质的量为__mol,该“加碘食盐”的含碘量为__mg·kg-1。
②将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO3-离子物质的量浓度为___________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中进行SO2的催化氧化反应.若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则下列叙述中正确的是( )
A.SO2的转化率为60%
B.SO3的产率为60%
C.平衡时总压强与起始压强之比为7:8
D.平衡时V(SO2):V(O2):V(SO3)=3:3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com