
【题目】过氧化钙可用于治理赤潮、应急供氧等。已知:过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢。某小组同学探究过氧化钙的制法和性质:
(1) 甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是______(填A、B)
方法A Ca (OH)2 (s) + H2O2 ![]() CaO2 (s) + 2H2O
CaO2 (s) + 2H2O
方法B CaCl2 (s) + H2O2 ![]() CaO2 (s) + 2HCl
CaO2 (s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是 ___________(填化学式)
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是______________。
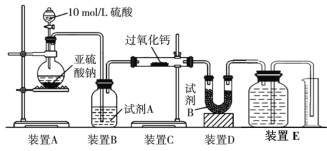
(2) 丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:
①试剂B的作用是____________________。
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:______________________________。
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =______。
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:

①用上述方法制备过氧化钙(CaO2·8H2O),搅拌步骤的化学方程式是______________。
温度(℃) | 50 | 40 | 30 | 20 | 10 | 0 |
产率 | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 |
②某小组釆用单变量法确定温度、H2O2浓度对产率的影响,结果如下:
H2O2 % | 30% | 25% | 20% | 15% | 10% | 5% |
产率 | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 |
则实际生产应选择的适宜条为__________。
【答案】B Ca (OH)2 反应是放热反应,使平衡向左移动,需要在较低温度下反应,为了提高原料利用率,避免双氧水在温度较高条件下分解。 干燥气体 2CaO2+2SO2=2CaSO3 + O2 0 CaCl 2 + H2O2 + 2NH3·H2O + 6 H2O = CaO2·8H2O↓ + 2NH4Cl 温度为30℃、H2O2浓度为20%
【解析】
⑴根据过氧化钙的特征得出产率的低的原因,A中产品不纯,主要含有没有反应的反应物,由于反应是放热反应,需要在较低温度下反应和加入稳定剂。
⑵①过氧化钙和水要反应,需要除掉水蒸气;②若SO2未被氧化,则二氧化硫和过氧化钙反应生成亚硫酸钙和氧气;③若SO2完全被氧化,则全部变为硫酸钙。
⑶根据反应流程得出反应方程式,根据数据得出实际生产应选择的适宜条件。
⑴过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢,因此甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是B;方法A所得产品中纯度不高,主要是含有没有反应的氢氧化钙;两个反应都是放热反应,需要在较低温度下反应,为了提高原料利用率,避免双氧水再温度较高条件下分解,因此需要加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是反应是放热反应,使平衡向左移动,需要在较低温度下反应,为了提高原料利用率,避免双氧水再温度较高条件下分解,故答案为:B;Ca(OH)2;反应是放热反应,使平衡向左移动,需要在较低温度下反应,为了提高原料利用率,避免双氧水再温度较高条件下分解。
⑵①过氧化钙和水要反应,需要除掉水蒸气,二氧化硫与过氧化钙反应,因此试剂B的作用是干燥气体,故答案为:干燥气体。
②若SO2未被氧化,则二氧化硫和过氧化钙反应生成亚硫酸钙和氧气,因此反应的化学方程式为:2CaO2+2SO2=2CaSO3 + O2,故答案为:2CaO2+2SO2=2CaSO3 + O2。
③若SO2完全被氧化,则全部变为硫酸钙,因此没有气体剩余,则V =0,故答案为:0。
⑶根据反应流程得出反应方程式CaCl 2 + H2O2 + 2NH3·H2O + 6 H2O = CaO2·8H2O↓ + 2NH4Cl,故答案为:CaCl 2 + H2O2 + 2NH3·H2O + 6 H2O = CaO2·8H2O↓ + 2NH4Cl。
②根据数据得出实际生产应选择的适宜条件为温度为30℃、H2O2浓度为20%,故答案为:温度为30℃、H2O2浓度为20%。


科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,生成四氧化三铁,并置换出氢气。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
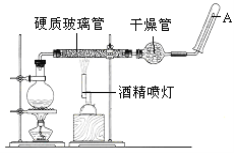
请回答该实验中的问题。
(1)写出该反应的化学方程式:________________________________________;该氧化还原反应的还原剂是_______________,氧化剂是_______________ 。
(2)实验前必须对整套装置进行的操作是_______________________。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是____________________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_________________________________。
(4)干燥管中盛装是的物质是________(填写名称),作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
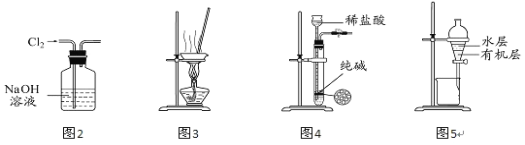
A.用图2所示装置除去Cl2中含有的少量HCl
B.用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图4 所示装置制取少量纯净的CO2气体
D.用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8。A元素原子的第二层电子数与第一、第三层电子数之和相等,D元素原子的第一、第二层电子数之和等于电子总数的一半。试回答下列问题。
(1)四种元素的符号依次是A___,B___,C__,D__;它们的原子半径由大到小的顺序是___。
(2)试写出四种元素的离子结构示意图:A___,B___,C___,D___。它们的离子半径由大到小的顺序是___(用离子符号表示)。
(3)分别写出四种元素的最高价氧化物对应水化物的化学式:__。
(4)分别写出A、B两元素的气态氢化物的化学式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
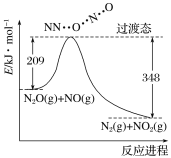
A.反应生成1 mol N2时转移4 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,如图表示反应时间 t时、温度 T 和压强P 与反应混合气体中 C 的体积分数(C%)的关系曲线,由曲线分析,下列判断正确的是
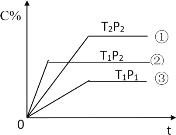
A.T1<T2 P1>P2 m+n<p ΔH>0
B.T1>T2 P1<P2 m+n>p ΔH<0
C.T1<T2 P1>P2 m+n<p ΔH<0
D.T1>T2 P1<P2 m+n>p ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )

A.若a=4,则A是强酸,B是弱酸
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.稀释前两种酸溶液的浓度:c(A)>c(B)
D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中,除氢原子外,每个原子最外层均达到8电子结构,则它们的结构式错误的是( )
A.氧分子:O=O
B.S2Cl2:Cl-S-S-Cl
C.氢氰酸:H-C![]() N
N
D.光气(COCl2):Cl-C-O-Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com