
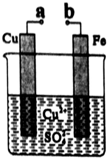
| A. | 无论a和b是否连接,该装置的反应原理相同 | |
| B. | a和b分别连接直流电源正、负极可以实现铁上镀铜 | |
| C. | a和b不连接时反应速率比a和b用导线连接时的速率慢 | |
| D. | 在a、b之间连接一小灯泡,改变Cu2+的浓度不会影响灯泡亮度 |
分析 A、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu;
B、实现铁上镀铜,则铁为阴极,铜为阳极;
C、a和b不连接时,Fe与硫酸铜溶液发生置换反应;a和b用导线连接时,形成原电池,加快了铁将金属铜从其盐中置换出来的速度;
D、改变Cu2+的浓度,则改变了电路中电流的大小.
解答 解:A、a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,a和b用导线连接时,形成了原电池,加快了铁将金属铜从其盐中置换出来的速度,无论a和b是否连接,铁片均会溶解,反应原理相同,故A正确;
B、实现铁上镀铜,则铁为阴极,铜为阳极,所以a和b分别连接直流电源正、负极,故B正确;
C、a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,a和b用导线连接时,形成了原电池,加快了铁将金属铜从其盐中置换出来的速度,故C正确;
D、在a、b之间连接一小灯泡,改变Cu2+的浓度,则改变了电路中电流的大小,影响灯泡亮度,故D错误.
故选D.
点评 本题考查学生化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,电解过程的反应原理应用,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫该物质的热值,单位为kJ•mol-1 | |
| B. | 某放热反应在其它条件不变时,加入催化剂后反应速率加快,同时会放出更多的热量 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H1;C5H12(g)+8O2(g)═5CO2(g)+6H2O(l)△H2.反应热△H1>△H2 | |
| D. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Y)>r(Z)>r(X) | |
| B. | X、Y、Z三种元素形成的化合物中只有共价键 | |
| C. | 最高价氧化物对应水化物的酸性:W>Y | |
| D. | 气态简单氢化物的热稳定性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
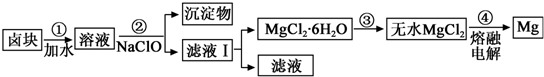
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 试剂 |
| A | 除去Fe2O3中的Al2O3 | 稀盐酸 |
| B | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
| C | 检验溴乙烷中含有溴元素 | 溴乙烷、NaOH溶液、AgNO3溶液 |
| D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溴保存时应加少量水并盛放在用玻璃塞塞紧的试剂瓶中 | |
| B. | 某气体通入品红溶液褪色,加热溶液又变红,该气体为SO2 | |
| C. | 配制硫酸亚铁溶液,可将绿矾晶体溶于蒸馏水并加入一定量的稀硫酸和铁屑 | |
| D. | 某溶液中加盐酸产生使澄清石灰水变浑浊的无色气体,则该溶液一定含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com