
工业上以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
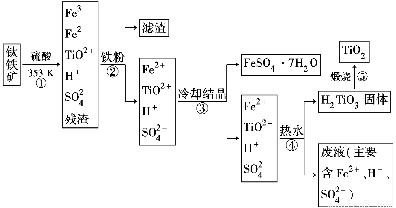
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________
(2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
____________________________________________________________。
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________
(6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。
写出阳极的电极反应式:_________________________

在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。
(1)2Fe3++Fe===3Fe2+ (2)b (3)过滤
(4)溶液中存在平衡:TiO2++2H2O??H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3 (5)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (6)①2O2--4e-=O2↑(或C+2O2--4e-=CO2↑) ②制备Ti时,发生反应:2CaO 2Ca+O2↑,2Ca+TiO2
2Ca+O2↑,2Ca+TiO2 Ti+2CaO,由此可见,CaO的总量不变(或制备Ti时,阴极发生反应;2Ca2++4e-===2Ca,阳极发生反应:2O2--4e-===O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的总量不变(或制备Ti时,阴极发生反应;2Ca2++4e-===2Ca,阳极发生反应:2O2--4e-===O2↑,2Ca+TiO2 Ti+2CaO,由此可见,CaO的总量不变)
Ti+2CaO,由此可见,CaO的总量不变)
【解析】(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为2Fe3++Fe=3Fe2+。(2)步骤③中,冷却结晶是利用物质在不同温度下的溶解性差异来实现混合物的分离的。(3)分析流程图可知,步骤②、③、④中均需进行的操作是过滤。(4)步骤③所得溶液中存在平衡:TiO2++2H2O??H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3。(5)废液中主要含有硫酸和硫酸亚铁,与软锰矿反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。(6)①电解槽的阳极发生氧化反应:2O2--4e-=O2↑(或C+2O2--4e-=CO2↑)。②制备金属钛时,发生反应:2CaO 2Ca+O2↑,2Ca+TiO2
2Ca+O2↑,2Ca+TiO2 Ti+2CaO由此可见,CaO的总量不变。
Ti+2CaO由此可见,CaO的总量不变。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
用下列实验装置进行相应实验,能达到实验目的的是 ( )。

A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:选择题
下列说法不正确的是( )。
A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解
B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
C.铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O
D.HNO3→NO→NO2,以上各步变化均能通过一步实现
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 基本概念、基本理论练习卷(解析版) 题型:填空题
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是____________________________________________(以化学方程式表示)。
(2)分析二甲醚合成反应(ⅳ)对于CO转化率的影响
________________________________________________________________________。
(3)有研究者在催化剂(含Cu?Zn?Al?O和Al2O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是_________________________________________________。

(4)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为__________
_____________________,一个二甲醚分子经过电化学氧化,可以产生________________个电子的电量;该电池的理论输出电压为1.20 V,能量密度E=_______________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:填空题
已知甲和乙在溶液中的转化关系如图所示: 。请回答下列问题:
。请回答下列问题:
(1)若甲是10电子的阳离子,乙是碱性气体。1 mol乙通入足量强酸溶液中与H+反应,反应过程中的能量变化如图。写出乙的一种用途________________。该反应的热化学方程式为___________________________。

(2)若甲是CO2,用CO2和NH3反应可以合成尿素,合成尿素的反应分为如下两步。
第一步:2NH3(l)+CO2(g) H2NCOONH4(l)(氨基甲酸铵) ΔH1
H2NCOONH4(l)(氨基甲酸铵) ΔH1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
在一体积为0.5 L的密闭容器中投入4 mol氨和1 mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如图Ⅰ所示。

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定。
②反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则前10 min用CO2表示的第一步反应的速率为________。
③第二步反应的平衡常数K随温度的变化如图Ⅱ所示,则ΔH2________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:

(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________。
(3)第④步通入CO2可以使MnO42—发生反应,生成MnO4—和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是______________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、________、洗涤、干燥。干燥过程中,温度不宜过高,因为____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
把物质的量均为0.1 mol的AlCl3、CuCl2和H2SO4溶于水配制成100 mL混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下的体积相同。则下列描述正确的是( )
A.电路中共转移0.9 mol电子
B.阳极得到的气体中有O2,且其物质的量为0.35 mol
C.阴极的质量增加3.2 g
D.铝元素仅以Al(OH)3的形式存在
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:选择题
设阿伏加德罗常数的数值用NA表示,下列叙述中正确的是( )
①在反应KIO3+6HI KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
②35.5 g Cl2中含有共价键数为NA
③0.44 g C3H8中含有的共价键总数目为0.1NA
④24 g镁的原子中最外层电子数为NA
⑤6.4 g的S2和S8混合物中,含硫原子总数为0.2NA
⑥在常温常压下,1 mol甲烷分子所含质子数为10NA
⑦1 mol冰醋酸与1 mol乙醇在加热和浓硫酸存在条件下充分反应生成的水分子数为NA
A.③⑤⑥B.②③④⑤C.②④⑥⑦D.①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:选择题
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法中正确的是( )
A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
B.化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键
C.用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀
D.X、Z两元素能形成原子个数比为3∶1和4∶2的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com