
 ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”). 分析 A的相对分子质量为84,根据商余法可得:$\frac{84}{14}$=6,A的化学式为C6H12,由于A分子中含有碳碳双键,则A为单烯烃己烯,又核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为: ,根据烯烃的命名原则写出其名称;结合乙烯、甲烷的空间结构判断该有机物分子中C原子是否共平面.
,根据烯烃的命名原则写出其名称;结合乙烯、甲烷的空间结构判断该有机物分子中C原子是否共平面.
解答 解:A的相对分子质量为84,根据商余法可得:$\frac{84}{14}$=6,A的化学式为C6H12,由于A分子中含有碳碳双键,则A为单烯烃己烯,又核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为: ,A分子中碳碳双键在2号C,甲基在2、3号C,则其名称为:2,3-二甲基-2-丁烯;
,A分子中碳碳双键在2号C,甲基在2、3号C,则其名称为:2,3-二甲基-2-丁烯;
由于碳碳双键是平面型结构,而4个甲基与不饱和碳原子又直接相连,所以6个碳原子处于同一平面上,
故答案为: ;2,3-二甲基-2-丁烯;是.
;2,3-二甲基-2-丁烯;是.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握判断有机物空间结构的方法,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ICl中I显-1价 | |
| B. | HI是反应的中间产物 | |
| C. | 总反应速率的快慢主要由反应②决定 | |
| D. | 总反应的热化学方程式为H2(g)+2ICl(s)=I2(s)+2HCl(g)△H=-109kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.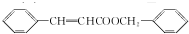 ,下列关于X的说法不正确的是bc(填字母).
,下列关于X的说法不正确的是bc(填字母). 或
或 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
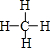 .
.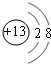 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
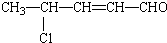 ,该有机物可能发生的反应( )
,该有机物可能发生的反应( )| A. | ①②③④⑦⑧ | B. | ①②③④⑤⑦⑧ | C. | ①②③④⑤⑦ | D. | ②③④⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com