
| A. | 使用催化剂能改变反应速率 | B. | 升高温度能加快反应速率 | ||
| C. | 降低压强能减小反应速率 | D. | 改变压强对反应速率没有影响 |
分析 A、使用催化剂不会引起平衡的移动,只改变反应速率;
B、升高温度加快反应速率;
C、改变压强对有气体参加的化学反应速率会产生影响;
D、对有气体参加的化学反应,压强对反应速率会产生影响.
解答 解:A、使用催化剂不会引起平衡的移动,不能改变平衡常数,故A错误;
B、升高温度可以提高活化分子百分数,加快反应速率,故B正确;
C、改变压强对有气体参加的化学反应速率会产生影响,对于无气体参加的反应无影响,所以降低压强能减小反应速率,故C正确;
D、对有气体参加的化学反应,改变压强会对反应速率有影响,故D错误.
故选D.
点评 本题考查学生影像化学反应速率的因素知识,注意知识的积累是解题的关键,难度不大.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
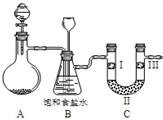 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
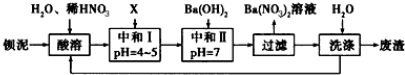
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②④⑥⑦ | C. | ③④⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
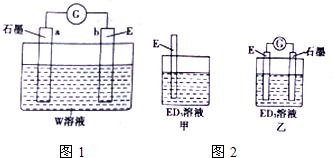
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个反应都是置换反应 | |
| B. | 每生成1mol金属Ti,②中转移电子数为2NA | |
| C. | ①中TiO2作氧化剂 | |
| D. | ②中氩气作保护气,可防止金属Ti被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(X)正=v(X)逆=0 | |
| B. | v(X):v(Y)=1:2 | |
| C. | 容器内X,Y,Z的浓度不随时间变化 | |
| D. | 单位时间消耗0.1mol X同时生成0.2mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H原子形成1 mol H-H键要吸收能量 | |
| B. | 所有燃烧的反应都是放热反应 | |
| C. | NaOH溶于水是放热反应 | |
| D. | 吸热反应是能量降低的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com