
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH | SO | NO | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

① N2(g)+O2(g) 2NO(g)△H= 。
2NO(g)△H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
⑴ 4 ⑵ ① +183kJ/mol;② 2NO+2CO 催化剂 2CO2+N2 ;③ 不能
⑶ ① SO2+I2+2H2O=SO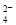 +2I-+4H+
+2I-+4H+
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行
③MH+OH--e-=H2O+M
【解析】
试题分析:(1)题目所示的微粒中阳离子所带的正电荷数是:4×10-6×1+6×10-6×1+2×10-5×1=3×10-5mol/L,阴离子所带的负电荷总数是:2×4×10-5+1×3×10-5+1×2×10-5=13×10-5 mol/L>3×10-5mol/L,根据溶液呈电中性原理,溶液中还应该含有大量的H+。所以溶液显酸性。c(H+)=13×10-5 mol/L-3×10-5mol/L=1×10-4 mol/L,所以pH=4. (2)①反应热就是断裂化学键吸收的热量与形成化学键释放的热量的差值。因此 N2(g)+O2(g 2NO(g)△H=+945KJ/mol+498KJ/mol-2×630KJ/mol=+183KJ/mol。②NO被CO还原的化学方程式为2NO+2CO 催化剂 2CO2+N2 ;③由于该反应是体系混乱程度减小的吸热反应,体系的自由能大于0,所以设想是不能实现的。① 根据图示可知:用离子方程式表示反应器中发生的反应是:SO2+I2+2H2O=SO
2NO(g)△H=+945KJ/mol+498KJ/mol-2×630KJ/mol=+183KJ/mol。②NO被CO还原的化学方程式为2NO+2CO 催化剂 2CO2+N2 ;③由于该反应是体系混乱程度减小的吸热反应,体系的自由能大于0,所以设想是不能实现的。① 根据图示可知:用离子方程式表示反应器中发生的反应是:SO2+I2+2H2O=SO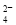 +2I-+4H+。②2HI(g)
+2I-+4H+。②2HI(g) H2(g)+I2(g). HI分解反应是可能反应。在反应中使用膜反应器分离出H2,减小生成物的浓度,平衡正向移动,有利于反应正向进行。③根据总反应方程式可知:在电池放电时,负极电极反应式为MH+OH--e-=H2O+M。
H2(g)+I2(g). HI分解反应是可能反应。在反应中使用膜反应器分离出H2,减小生成物的浓度,平衡正向移动,有利于反应正向进行。③根据总反应方程式可知:在电池放电时,负极电极反应式为MH+OH--e-=H2O+M。
考点:考查PM2.5的溶液的酸碱性、热化学方程式与化学键的关系、浓度对平衡移动的影响、离子方程式的书写、镍氢电池的电极反应式的书写的知识。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
A.降低温度 B.恒容充入氮气 C.恒压充入氦气 D.恒容充入氦气
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市5月高三月考理综化学试卷(解析版) 题型:选择题
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。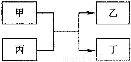 下列说法正确的是
下列说法正确的是
A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
B. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:选择题
化学学习中,推理是一种重要的学习方法,下列推论正确的是
A.由“BF3和SO3互为等电子体”,可推知二者均为非极性分子
B.由“同主族元素性质相似,CO2为直线形分子”,可推知SiO2为直线形分子
C.由“SiH4的熔沸点比CH4高”,可推知PH3的熔沸点比NH3高
D.由“C、N、O三种元素的电负性C<N<O”,可推知第一电离能C<N<O
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
下列实验对应的结论正确的是:
| A | B | C | D |
装 置 |
|
|
|
|
结 论 | 实验室制取乙炔 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶 液反应生成的碘 | 白色沉淀是BaSO3 |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH—)=2c(H+)+c(HA)-c(A—)
B.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2—)+c(HR—)=c(Na+)
D.某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则该溶液的pH一定为14-a
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:简答题
(16分)某药学杂志报道了一种具有明显抗癌活性的药物,其结构如图所示。J是其同分异构体,J的合成路线如下(部分产物已略去):
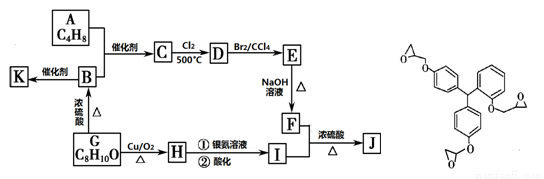
已知:① CH2=CHR1 + CH2=CHR2  CH2=CH2 + R1CH=CHR2
CH2=CH2 + R1CH=CHR2
② R—CH2—CH=CH2 + Cl2 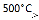 R—CHCl—CH=CH2 + HCl
R—CHCl—CH=CH2 + HCl
③ 核磁共振氢谱图显示A分子中不同环境氢原子个数比为3 :1;F是油脂水解的产物之一,能与水以任意比例混溶;K是一种高分子化合物。
请回答下列问题:
(1)该药物可能具有的性质是 (填字母编号)。
a.易溶于水 b.能发生加成反应 c.能发生水解反应 d.能发生取代反应
(2)H分子中含有官能团的名称是 ;G的结构简式为 。
(3)按照系统命名法,A的名称是 。
(4)C→D的反应类型为 。
(5)写出下列反应的化学方程式:
B→K ;F+I→J 。
(6)写出同时满足下列条件的I的所有同分异构体的结构简式 。
①分子中含有苯环结构;②能发生银镜反应;③苯环上的一氯代物有两种。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向等浓度且较稀的NaCl、KI混合 液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 向溶液x中滴加浓NaOH溶液, 将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
C | 溴乙烷与NaOH溶液共热后,加入 AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解
|
D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34g/mol,Y的最低价氢化物为非电解质。则下列说法中正确的是
| X | Y |
|
Z |
| W | Q |
A.阴离子还原性:W > Q
B.X的最低价氢化物能形成分子间氢键
C.Q单质能溶于水,且水溶液须用棕色细口瓶盛装
D.Na与Y能形成化合物Na2Y2,且与水反应后溶液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com