
【题目】下图是研究铁钉腐蚀的装置图,下列说法不正确的是
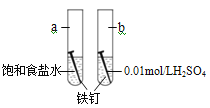
A. 铁钉在两处的腐蚀速率:a < b
B. a、b两处铁钉中碳均正极
C. a、b两处铁钉中的铁均失电子被氧化
D. a、b两处的正极反应式均为O2+4e-+4H+===2H2O
【答案】D
【解析】
试题a中电解质溶液显中性,为铁钉的吸氧腐蚀,b中电解质溶液为稀硫酸,显酸性为析氢腐蚀;
A、硫酸中氢离子浓度较大,电池反应较快,饱和食盐水中氧气的浓度较小,电池反应较慢;
B、a、b中C为原电池的正极;
C、a、b中Fe失电子为原电池的负极;
D、a中正极上氧气的得电子,b中正极上氢离子得电子.
解:a中电解质溶液显中性,为铁钉的吸氧腐蚀,b中电解质溶液为稀硫酸,显酸性为析氢腐蚀;
A、硫酸中氢离子浓度较大,电池反应较快,饱和食盐水中氧气的浓度较小,电池反应较慢,所以ab在两处的腐蚀速率a<b,故A正确;
B、a中C为原电池的正极,正极上氧气得电子,b中C为原电池的正极,正极上氢离子得电子,故B正确;
C、原电池中失电子的一极为负极,a、b中Fe失电子为原电池的负极,故C正确;
D、a中正极上氧气得电子,其电极反应式为O2+4e﹣+2H2O═4OH﹣,b中正极上氢离子得电子,其电极反应式为2H++2e﹣=H2↑,故D错误;
故选D.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】铜锌原电池装置(见图),下列分析正确的是( )

A. 一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B. 原电池工作时,Cu电极流出电子,发生反应:Cu-2e-===Cu2+
C. 原电池工作时,Zn电极发生还原反应:Zn2++2e-===Zn
D. 原电池工作时的总反应为Zn+Cu2+===Zn2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是
A. 操作①和③中的有机相从分液漏斗上端倒出
B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42-
C. 操作④为过滤
D. 操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),达到平衡时 X、Y、Z的物质的量分别为 0.1mol、0.3mol、0.2mol,保持温度和容器体积不变时,再向容器中充入X、Y、Z的物质的量0.1mol、0.3mol、0.2mol,则下列说法正确的是
2Z(g),达到平衡时 X、Y、Z的物质的量分别为 0.1mol、0.3mol、0.2mol,保持温度和容器体积不变时,再向容器中充入X、Y、Z的物质的量0.1mol、0.3mol、0.2mol,则下列说法正确的是
A. 化学平衡常数不变,平衡不移动 B. 向正反应方向移动
C. 向逆反应方向移动 D. 容器内压强始终保持原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

A. T1>T2 △H > 0
B. 该反应进行到M点放出的热量等于进行到W点放出的热量
C. M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 平衡常数K3
2CH3OH(g) △H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:H2(g)+I2(g) === 2HI(g) △H= -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式_________________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如右图所示。


①T℃时该化学反应的平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_______移动。(填“向左”、“向右”或“不)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_______。
Ⅱ.SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-。该反应的离子方程式是___________________。
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____________,阴极的电极反应式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com