
 ,反应类型为酯化反应.
,反应类型为酯化反应.分析 (1)浓硫酸增重为水的质量,碱石灰增重为二氧化碳的质量,以此可确定有机物中C、H原子个数比值;根据有机物与足量的金属钠反应产生氢气,可知物质中含有氧原子,根据讨论法,结合相对分子质量为46以及有机物与氢气的关系可确定分子式与结构简式;
(2)根据乙醇在一定条件下脱水可生成B,B为CH2=CH2,B可合成包装塑料C,C为聚乙烯;
(3)根据乙醇被氧化为乙酸,乙酸与乙醇能发生酯化反应生成酯和水,酯化反应为取代反应;
(4)原子利用率为100%,说明生成物只有一种,可用加成方法制备.
解答 解:(1)n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H)=2n(H2O)=$\frac{5.4g}{18g/mol}$×2=0.6mol,则有机物中N(C):N(H)=0.2mol:0.6mol=1:3;化合物A的相对分子质量为46,若分子中含有一个氧原子,则碳原子与氢原子的个数分别为2、6,为乙醇或二甲醚,n(乙醇):n(氢气)=2:1,符合题意;但二甲醚与钠不反应,不符合题意;若分子中含有2个氧原子,则碳原子与氢原子的个数分别为0.93、2.8,不符合题意,所以化合物A的分子式为C2H6O,结构简式为CH3CH2OH;
故答案为:1:3;CH3CH2OH;
(2)乙醇在一定条件下发生消去反应可生成B,B为CH2=CH2,B可合成包装塑料C,C为聚乙烯,A转化为B的化学反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)发生一系列的化学变化而变得更醇香,应为乙醇被氧化为乙酸,进而发生酯化反应生成乙酸乙酯,反应的方程式为: ,该反应为酯化反应,
,该反应为酯化反应,
故答案为: ;酯化反应;
;酯化反应;
(4)原子利用率为100%,可用加成方法制备,反应的方程式为:CH2=CH2 +HCl $→_{△}^{催化剂}$CH3CH2Cl,该反应为加成反应,
故答案为:CH2=CH2 +HCl $→_{△}^{催化剂}$CH3CH2Cl.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,根据讨论法确定有机物的结构简式为解答该题的关键,注意掌握常见有机物结构与性质,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式 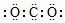 | B. | Cl-的结构示意图 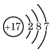 | ||
| C. | HCl的电子式 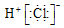 | D. | 质量数为37的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
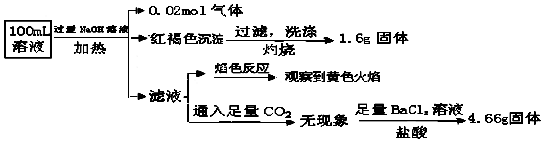
| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )| A. | 该反应的平衡常数表达式为:K=$\frac{{C}_{(C)}}{{{C}^{2}}_{(A)}•{C}_{(B)}}$ | |
| B. | 0~4 min时,A的平均反应速率为0.01 mol/(L•min) | |
| C. | 由T1向T2变化时,v正>v逆 | |
| D. | 平衡后升高温度,K值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com