
实验室用NaOH固体配制480mL 1.0mol/L的NaOH溶液,请回答下列问题:
(1)应称取NaOH固体的质量 g
(2)实验仪器除了托盘天平、药匙、烧杯、玻璃棒外,还应有
(3)容量瓶上需标有以下五项中的 (序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)使用容量瓶前必须进行的一步操作是 .
(5)配制时,其正确的操作顺序是
A、用30mL水洗涤烧杯2﹣3次,洗涤液均转入容量瓶,振荡
B、用托盘天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切
F、继续往容量瓶内小心加水,直到液面接近刻度线1﹣2cm处
(6)下列配制的溶液浓度偏大的是
A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、未洗涤溶解NaOH的烧杯
D、定容时俯视刻度线.
考点:
配制一定物质的量浓度的溶液.
专题:
实验题.
分析:
(1)根据m=CVM计算溶质的质量;
(2)根据配制溶液的操作步骤选择所用仪器,进而判断缺少的仪器;
(3)容量瓶上需标有温度、容量、刻度线;
(4)溶液配制最后需要反复上下颠倒摇匀,故使用容量瓶之前需要检查容量瓶是否漏水;
(5)根据配制溶液的操作步骤,进行操作步骤排序;
(6)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=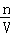 分析对溶液浓度的影响.
分析对溶液浓度的影响.
解答:
解答:解:(1)m=CVM=1mol/L×0.5L×40g/mol=20g,故答案为:20g;
(2)溶液配制过程中,用烧杯溶解烧碱,用玻璃棒搅拌和引流,用500mL的容量瓶配制溶液,用胶头滴管定容,用托盘天平称量烧碱,用药匙取药品,实验仪器除了托盘天平、药匙、烧杯、玻璃棒外,还应有500mL容量瓶、胶头滴管,故答案为:500mL容量瓶、胶头滴管;
(3)容量瓶上需标有温度、容量、刻度线,故答案为:①③⑤;
(4)溶液配制最后需要反复上下颠倒摇匀,故使用容量瓶之前需要检查容量瓶是否漏水,
故答案为:检查容量瓶是否漏水;
(5)配制溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,所以其排序是BCAFED,
故答案为:BCAFED;
(6)A.NaOH溶解时放出大量的热,未冷却立即配制溶液,导致溶液的体积偏小,则配制溶液的浓度偏高;
B.向容量瓶中转移溶液时不慎洒出,导致溶质的物质的量偏小,则配制溶液的浓度偏低;
C.溶解NaOH固体之后的烧杯未洗涤,导致溶质的物质的量偏小,则配制溶液的浓度偏低;
D.定容时俯视刻度线,导致溶液的体积偏小,则配制溶液的浓度偏高;
故选AD.
点评:
本题考查了一定物质的量浓度溶液的配制,难度不大,注意计算氢氧化钠的质量时,V应该是500mL而不是480mL,为易错点.


科目:高中化学 来源: 题型:
下列说法正确的是( )
-A.-常温下,4.4g N2O和CO2的混合气体中所含有的原子数约为0.3×6.02×l023
-B.-含1 mol FeCl3的饱和溶液完全与水反应生成1mol Fe(OH)3胶体粒子
-C.-标准状况下,1mol任何物质的体积都大约为22.4L
-D.-根据分散系的稳定性大小将分散系分为胶体、溶液和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用NaOH固体配制480mL 1.0mol/L的NaOH溶液,请回答下列问题:
(1)应称取NaOH固体的质量 g
(2)实验仪器除了托盘天平、药匙、烧杯、玻璃棒外,还应有
(3)容量瓶上需标有以下五项中的 (序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)使用容量瓶前必须进行的一步操作是 .
(5)配制时,其正确的操作顺序是
A、用30mL水洗涤烧杯2﹣3次,洗涤液均转入容量瓶,振荡
B、用托盘天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切
F、继续往容量瓶内小心加水,直到液面接近刻度线1﹣2cm处
(6)下列配制的溶液浓度偏大的是
A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、未洗涤溶解NaOH的烧杯
D、定容时俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子的检验方法中正确的是( )
|
| A. | 某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl﹣ |
|
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42﹣ |
|
| C. | 某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
|
| D. | 某溶液加KOH溶液生成红褐色沉淀,说明原溶液中有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1mol/L的是( )
|
| A. | 将40g NaOH溶解在1L水中 |
|
| B. | 将22.4L HCl气体溶于水配成1L溶液 |
|
| C. | 从1L 2mol/L的H2SO4溶液中取出0.5L |
|
| D. | 将10g NaOH溶解在少量水中,再加蒸馏水至溶液体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
向水中加入等物质的量Ag+、Na+、Pb2+、Cl﹣、SO42﹣、NO3﹣,用惰性电极电解所得溶液,一段时间后氧化产物与还原产物物质的量之比为()
A. 8:1 B. 2:1 C. 1:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合.(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
(1)写出化学式:A1 ,A2 ,B1 ,B2 ;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为 ;常温下,若B1、B2两溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为
(3)相同浓度的四种溶液的pH值由大到小的顺序为: ;(用物质的化学式填写)
(4)写出0.1mol/L的A2溶液中离子浓度大小排序 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:醋酸是弱酸,其电离过程的△H>0,而强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH﹣(aq)═H2O(l);△H=﹣57.3kI/mol,向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时的反应热△H1、△H2、△H3的关系正确的是()
A. △H1>△H2>△H3 B. △H1<△H3<△H2 C. △H1<△H2<△H3 D. △H1>△H3>△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com