
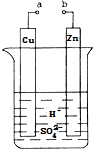
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:分析 a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应产生氢气,电解质溶液中阳离子向正极移动;电子由锌片经导线流下铜片,据此分析.
解答 解:a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应产生氢气,电解质溶液中阳离子向正极移动;电子由锌片经导线流下铜片
(1)a和b用导线连接,该装置构成原电池,铜作正极,故答案为:正;
(2)铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故现象为产生气泡,故答案为:产生气泡;
(3)锌片为负极,失去电子发生氧化反应,电极方程式为Zn-2e-=Zn2+,故答案为:氧化;Zn-2e-=Zn2+;
(4)电子由锌片经导线流下铜片,故答案为:Cu;
(5)电解质溶液中阳离子向正极移动,故答案为:Cu.
点评 本题考查原电池原理、氧化还原反应的有关计算等知识点,明确能设计成原电池的反应特点,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{6A%}{7}$ | B. | $\frac{1-A%}{7}$ | C. | $\frac{6(1-A%)}{7}$ | D. | (100-$\frac{7A}{6}$)% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OOCCH2COOC2H5 | B. |  | ||
| C. | CH3COOCH2CH2COOCH3 | D. | CH3COOCH2COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
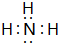 .e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为
.e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为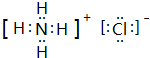 .
.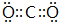 .z单质的电子式为
.z单质的电子式为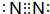 ,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为
,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为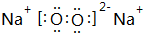 .用电子式表示x和d原子个数为1:1的化合物的形成过程
.用电子式表示x和d原子个数为1:1的化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 性质或结构信息 |
| A | 组成有机物的必须元素 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③⑤⑥ | C. | ③⑤⑥⑦ | D. | ①②④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com