
(10分)(1)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g) 2N2O5(g);
若已知K350℃< K300℃,则该反应是_______反应(填“吸热”或“放热”)。
反应达平衡后,若再通入一定量NO2,则平衡常数K将______,NO2的转化率 (填“增大”、“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
① 写出该反应的平衡常数表达式:K= 。
②1000 s内N2O5的分解速率为 。
③若每有1molN2O5分解,放出或吸收QkJ的热量,写出该分解反应的热化学方程式 。
科目:高中化学 来源: 题型:
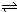 N2O4(g)达到平衡.
N2O4(g)达到平衡.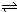 N2O4(g)的平衡常数K.
N2O4(g)的平衡常数K.查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com