
已知MnO2与浓盐酸可以发生如下反应:
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,若产生7.1gCl2,则:
MnCl2+Cl2↑+2H2O,若产生7.1gCl2,则:
(1)参加反应的HCl是多少克?
(2)被氧化的HCl是多少克?
(3)参加反应的MnO2物质的量是多少?
| 化学方程式的有关计算. | |
| 分析: | 根据方程式计算参加反应HCl、MnO2的质量,根据n= |
| 解答: | 解:(1)设参加反应HCl的质量为m,则: 4HCl(浓)+MnO2 146 71 m 7.1g 则m= 答:参加反应HCl的总质量为14.6g. (2)被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl物质的量=2n(Cl2)=2× 答:被氧化HCl的质量为7.3g. (3)设参加反应MnO2的质量为x,则: 4HCl(浓)+MnO2 87 71 x 7.1g 则x= 参加反应MnO2的物质的量为 答:参加反应MnO2的物质的量为0.1mol. |
| 点评: | 本题考查化学方程式有关计算,比较基础,侧重对基础知识的巩固. |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0 ~6.0之间,通过电解生成Fe(OH)3 沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计如图所示装置示意图。
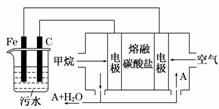
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
A.BaSO4 B.CH3CH2OH
C.Na2SO4 D.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ.______________;Ⅱ.______________。
(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是________________________________________________________________________。
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
表示溶液中浓度的方法通常有两种:溶液中溶质的质量分数(%)和物质的量浓度(C),因此在配制溶液时,根据不同的需要,有不同的配制方法,如:(请完成填空)
(1)用10%(密度为1.01g/cm3)的氢氧化钠溶液配制成27.5g2%的氢氧化钠溶液.
①计算:需5.5g10%(密度为1.01g/cm3)的氢氧化钠溶液,其体积为5.4mL,需加22mL水(ρ水=1g/cm3)进行稀释.
②量取:用10ml量筒取10%氢氧化钠,量取时视线要跟量筒凹液面的最低处保持水平,然后倒入烧杯里,用25ml量筒量取蒸馏水也注入烧杯里.
③溶解:用玻璃棒将上述溶液搅拌均匀,即得27.5g2%的氢氧化钠溶液.
(2)用98%(密度为1.84g/cm3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
①需要取浓硫酸16.3mL;
②配制操作可分解成如下几步,以下正确的操作顺序是ADECBHGF.
A、向容量瓶中注入少量蒸馏水,检查是否漏水
B、用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C、用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D、根据计算,用量筒量取一定体积的浓硫酸
E、将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F、盖上容量瓶塞子,振荡,摇匀
G、用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H、继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)实验室需配制1mol•L﹣1的NaOH溶液和1mol•L﹣1的H2SO4溶液各100mL.
①要配制NaOH溶液,在用托盘天平称取NaOH固体时,天平读数为C.(填代号)
A.4.0g B.4.00g C.>4.0g
②在配制NaOH溶液和H2SO4溶液的各步操作中,有明显不同的是AB.
A.称量或量取 B.溶解 C.移液、洗涤 D.定容.
查看答案和解析>>
科目:高中化学 来源: 题型:
冰箱致冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3(臭氧)→ClO+O2 ClO+O﹣→Cl+O2 下列说法不正确的是()
| A. | 反应将O3转变为O2 | B. | Cl原子是总反应的催化剂 | |
| C. | 氟氯甲烷是总反应的催化剂 | D. | Cl原子反复起分解O3的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是某地市场上销售的一种“加碘盐”包装袋上的部分文字说明.请根据此表,结合初中学过的化学知识,回答下列问题:
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 20~40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 食用方法 | 烹调时待食品熟后加入碘盐 |
(1)碘酸钾属于哪类物质?纯净物 (填:“纯净物”、“混合物”、“单质”、“氧化物”).
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时易分解.
(3)我国规定,食盐含碘量为每千克食盐含碘0.035克,相当于每千克食盐含碘酸钾0.06克.
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:
A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,错误的是
A.酸碱中和反应属放热反应
B.化学变化中的能量变化主要由化学键变化引起的
C.煤、石油、天然气是当今世界最重要的三种化石燃料
D.相同条件下,1mol石墨转化为金刚石要吸收1.895kJ热量,说明金刚石比石墨稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com