
| A. | 1.8×10-7 mol•L-1 | B. | 1.0×10-5 mol•L-1 | ||
| C. | 1.0×10-7 mol•L-1 | D. | 1.8×10-9 mol•L-1 |
分析 pH=12的NaOH溶液中c(OH-)=0.01mol/L,结合Ksp[Mg(OH)2]=1.8×10-11 mol3•L-3计算.
解答 解:pH=12的NaOH溶液中c(OH-)=0.01mol/L,由Ksp[Mg(OH)2]=1.8×10-11 mol3•L-3可知,c(Mg2+)=$\frac{1.8×1{0}^{-11}}{(0.01)^{2}}$=1.8×10-7 mol•L-1,即Mg(OH)2在pH=12的NaOH溶液中的溶解度为1.8×10-7 mol•L-1,
故选A.
点评 本题考查难溶电解质的计算,为高频考点,把握Ksp与离子浓度的关系为解答的关键,侧重分析与计算能力的考查,注意镁离子浓度等于溶解的氢氧化镁浓度,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
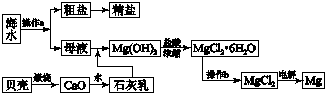
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物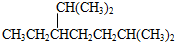 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使高锰酸钾溶液褪色 | |
| D. | 结构片段为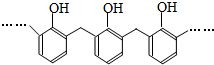 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀 | / |
| 步骤2:取适量步骤1滤液于试管中,滴加稀硫酸 | 生成白色沉淀,说明该试剂中含有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,… | …,说明该试剂中含有BaCO3 |
| 步骤4:… | … |
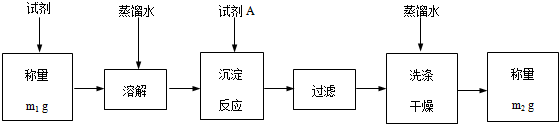
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
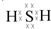 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
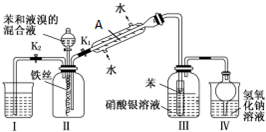

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com