
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
(1)基态铜原子的电子排布式为 ;已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是 。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se Si(填“>”、“<”)。
(3)SeO2常温下白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体的晶体类型为 ;若SeO2类似于SO2是V型分子,则Se原子外层轨道的杂化类型为 。
(4)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为 ,B与N之间形成 键。
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 个;若晶胞的边长为a pm,则金刚砂的密度表达式为 g/cm3。

【答案】
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1; CuO中铜的价层电子排布为3d 94s0,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是
(2)V形、正四面体;>
(3)分子晶体;sp2
(4)sp3;配位
(5)原子晶体;12;![]() 或
或![]()
【解析】
试题分析:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1;CuO中铜的价层电子排布为3d94s0(1分),Cu2O中铜的价层电子排布为3d10,3d10为稳定结构,所以在高温时,能生成Cu2O;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别V形,正四面体;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si;
(3)SeO2常温下白色晶体,熔、沸点低,为分子晶体;二氧化硒分子中价层电子对=2+![]() (6-2×2)=3,Se原子的杂化类型为sp2,且含有一个孤电子对,所以属于V形;
(6-2×2)=3,Se原子的杂化类型为sp2,且含有一个孤电子对,所以属于V形;
(4)BF3NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键;
(5)金刚砂(SiC)的硬度为9.5,属于原子晶体;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个碳原子周围最近的碳原子数目为3×4=12;该晶胞中C原子个数=8×![]() +6×
+6×![]() =4,Si原子个数为4,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,ρ=
=4,Si原子个数为4,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,ρ=![]() =
=![]() gcm3=
gcm3=![]() gcm3。
gcm3。


科目:高中化学 来源: 题型:
【题目】溴化钙可用于石油钻井,也可用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr22H2O的主要流程如下:

工业提取液溴主要采用空气吹出法,其主要流程如下:

请回答:
(1)Fe与液溴的反应温度不能超过40℃的原因是_________。
(2)试剂B最好选用_________。
(3)操作Ⅰ的步骤为蒸发浓缩、、________、洗涤、干燥。
(4)下列说法中错误的是_________。
a.滤渣A的成分可能是Fe、Fe(OH)2 、Fe(OH)3;
b.操作Ⅱ的名称是萃取
c.流程图中虚线框部分步骤的主要目的是除去杂质、富集Br2
d.成品溴中含有的少量Cl2,可加入Na2SO3溶液,然后分液除去
(5)制得的CaBr22H2O可以通过以下方法测定纯度:称取5.00 g样品溶于水,滴入足量Na2CO3溶液,充分反应后抽滤,将沉淀洗涤、烘干、冷却、称量,得到2.00 g固体。
①抽滤时用到的仪器除了安全瓶、抽气泵外,还需要_____________________________。
②抽滤中洗涤沉淀的操作方法是_________。
③以下关于抽滤的操作不正确的是________________
A.放在布氏漏斗内的滤纸大小应略小于漏斗内径,但又能将全部小孔盖住
B.过滤时,溶液量不应超过漏斗容量的2/3
C.吸滤瓶内液面将达到支管口时,应拔掉抽滤瓶上的橡皮管,从支管口处倒出溶液
D.停止吸滤时,应先拆下连接抽气泵和抽滤瓶的橡皮管,然后关闭水龙头
④测得CaBr22H2O的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率 。
(2)2s时A的物质的量浓度为 。
(3)2s时B的物质的量为 。
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/LH2SO4溶液中,乙同学将电极放入6mol/LNaOH溶液中,如图:
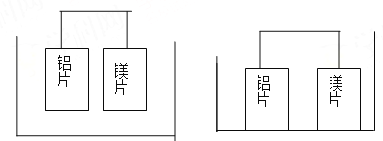
甲(H2SO4溶液) 乙(NaOH溶液)
(1)写出甲池中正极的电极反应式: ,负极的电极反应式: 。
(2)写出乙池中负极的电极反应式: ,乙池中总反应的离子方程式: 。
(3)如果甲和乙同学均认为,“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强。
(5)丙同学依据甲、乙同学的思路,设计如下实验:将铝片和铜片用导线相连.一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成了原电池。
①在这两个原电池中,负极分别为________。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
②写出插入浓硝酸中形成原电池的总反应化学方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光。下列有关该电池的说法正确的是( )

A.铜片上的电极反应:Cu2++2e﹣=Cu
B.电子通过溶液由锌片流向铜片
C.电池工作时电能直接转化为化学能
D.该电池工作时,若有16.25gZn被溶解,导线中转移0.50mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池将是21世纪获得电能的重要途径。近几年开发的丁烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

请回答下列问题:
(1)Pt(b)电极是电池的________极,电极反应式为_____________________________;Pt(a)电极发生________反应(填“氧化”或“还原”),电极反应式为____________。
(2)若电解质溶液改为KOH溶液,Pt(b)电极的电极反应式为_____________;Pt(a)电极的电极反应式为_____________________________________________________________。
(3)如果该电池工作时电路中通过1.2 mol电子,则消耗掉O2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述错误的是( )
2SO3(g)△H=﹣QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述错误的是( )
A.增大氧气浓度,平衡正向移动,平衡常数不变
B.降低温度,正反应速率比逆反应速率减小的程度小
C.平衡时SO2气体的转化率为50%
D.该条件下反应放出0.5QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是

A. 原电池的总反应为 Fe+Cu2+=Fe2++Cu
B. 反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C. 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D. 盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度= ,
(2)B的平均反应速率v(B)= ,
(3)x= ,
(4)开始时容器中的压强与平衡时的压强之比为 (化为最箭整数比)
II.将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)

(5) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(6)当消耗甲烷的体积为11.2 L(标准状况下)时,则消耗KOH的物质的量为 。
(7)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4gNH3转移的电子数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com