
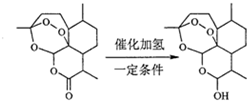
| A. | 青蒿素分子中治疗疟疾的活性基团是过氧基 | |
| B. | 双氢青蒿素分子比青蒿素分子多1个手性碳原子 | |
| C. | 理论上每摩尔青蒿素水解需要消耗1molNaOH | |
| D. | 每摩尔双氢青蒿素可以与1molNaHCO3反应生成1molCO2 |
分析 A.过氧基具有强氧化性;
B.青蒿素手性碳原子如 ,所以有7个;双氢青蒿素分子内含有8个手性碳原子;
,所以有7个;双氢青蒿素分子内含有8个手性碳原子;
C.青蒿素水解含有酯基,可在碱性条件下水解;
D.双氢青蒿素与碳酸氢钠不反应.
解答 解:A.过氧基具有强氧化性,可用于杀菌消毒,故A正确;
B.青蒿素手性碳原子如 ,所以有7个;双氢青蒿素分子内含有8个手性碳原子,比青蒿素中多连接羟基的碳原子,故B正确;
,所以有7个;双氢青蒿素分子内含有8个手性碳原子,比青蒿素中多连接羟基的碳原子,故B正确;
C.青蒿素水解含有酯基,可在碱性条件下水解,水解需要消耗1molNaOH,故C正确;
D.双氢青蒿素与碳酸氢钠不反应,故D错误.
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,难点是判断手性碳原子个数,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120mL | B. | 150mL | C. | 200mL | D. | 220mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
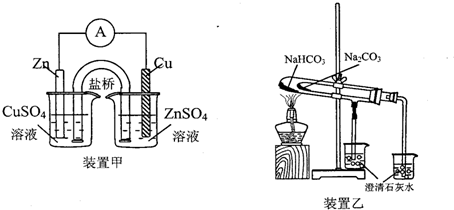
| A. | 用装置甲组装铜锌原电池 | |
| B. | 用装置乙比较NaHCO3和Na2CO3的热稳定性 | |
| C. | 配制1L0.010mol•L-1的纯碱溶液时用精度为0.1g的天平秤取1.06gNa2CO3 | |
| D. | 中和滴定时,锥形瓶用蒸馏水清洗2次后不烘干就盛放一定量的待测稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子是由原子核和核外电子构成的 | |
| B. | 保持水的化学性质的粒子是水分子 | |
| C. | 分子的质量总比原子的质量大 | |
| D. | 在化学反应中分子可分而原子不可分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,准确称取14.8gCa(OH)2,配置100mL2.0mol/L的Ca(OH)2溶液 | |
| B. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,震荡,静置、分液,得下层液体 | |
| C. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去氯化钠中的泥沙-过滤 | |
| B. | 用四氯化碳提取溴水中的溴单质-萃取 | |
| C. | 分离汽油和水-分液 | |
| D. | 除去碳酸氢钠固体中的碳酸钠-加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com