
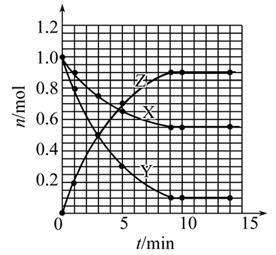
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是_____________________________________
___________________________________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:____________
_____________________________________;
(4)该反应达到平衡时反应物X的转化率α等于______________。
【解析】(1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
(2)根据题意,可以利用“三步法”求解
aX + bY cZ
cZ
开始/mol 1.00 1.00 0
转化/mol 0.45 0.9 0.9
平衡/mol 0.55 0.1 0.9
根据转化的物质的量之比等于化学方程式的系数比,可得X+2Y 2Z。
2Z。
(3)根据表中数据可知在3 min时,Z的物质的量为0.5 mol, 其平均速率为
0.083 mol·L-1·min-1。
(4)X的转化率=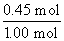 ×100%=45%。
×100%=45%。
答案:(1)
(2)X(g)+2Y(g) 2Z(g)
2Z(g)
(3)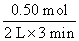 ≈0.083 mol·L-1·min-1
≈0.083 mol·L-1·min-1
(4)45%


科目:高中化学 来源: 题型:
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② .

查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
|
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO﹣)>c(OH﹣)>c(H﹣) |
|
| B. | 等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3) |
|
| C. | 将0.2mol.L﹣1的某一元酸HA溶液和0.1mol.L﹣1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH﹣)+c(A﹣)=2c(H+)+c(HA) |
|
| D. | 某溶液中水电离出的c(OH﹣)=1×10﹣amol.L﹣1若a>7时,则pH该溶液的一定为14﹣a |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
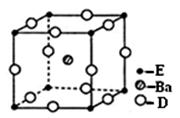 (4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
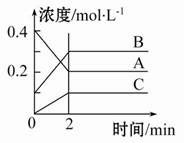
A.发生的反应可表示为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
B.前2 min A的分解速率为0.1mol·L-1·min-1
C.开始时,正逆反应同时开始
D.2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置设计正确且能达到目的的是
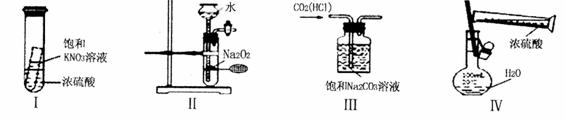
A.实验I:静置一段时间,小试管内有晶体析出 B. 实验II:制取氧气
C. 实验III除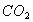 气体中的HCL D.实验IV:配制一定物质的量浓度的稀硫酸
气体中的HCL D.实验IV:配制一定物质的量浓度的稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 现将体积比为
现将体积比为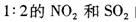 的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. 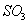 与
与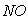 的体积保持不变 D.每消耗1mol
的体积保持不变 D.每消耗1mol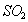 同时生成1mol
同时生成1mol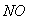
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①H2O(g)====H2O(l) ΔH=- Q 1 kJ·mol-1
②C2H5OH(g)====C2H5OH(l) ΔH=- Q 2 kJ·mol-1
③C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1
下列判断正确的是( )
A.酒精的燃烧热为Q3 kJ
B.若使23 g液态酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3) kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.由反应③可知1 mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+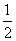 O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+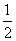 O2(g)===H2O(g) ΔH=242 kJ·mol-1
O2(g)===H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com