
下列溶液中的离子一定能大量共存的是
A.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
B.室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO-
C.能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32-
D.含大量Fe3+的溶液中:NH4+、Na+、C1-、SCN-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届浙江省高三上学期月考(三)化学试卷(解析版) 题型:实验题
CoCl2•6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 、 。
(4)“操作1”中包含的基本实验操作,它们依次是 和过滤、减压烘干。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。.

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
在2 L容器中发生3A+B  2C的反应,最初加入的A、B都是4 mol,若10 s 后反应达到平衡,测得A的平均反应速率为0.15 mol·L-1·s-1,则10 s后容器内B的物质的量为
2C的反应,最初加入的A、B都是4 mol,若10 s 后反应达到平衡,测得A的平均反应速率为0.15 mol·L-1·s-1,则10 s后容器内B的物质的量为
A.1.5 mol B.1.0 mol C.3.0 mol D.2.4 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高一上学期期中测试化学试卷(解析版) 题型:填空题
标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液,求:
(1)所得盐酸的物质的量浓度为 ;
(2)若将此溶液再稀释成1L溶液,则稀释后盐酸的物质的量浓度变为 ;
(3)将(2)的溶液取出250mL与足量Zn反应可以产生的H2在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期期中联考化学试卷(解析版) 题型:选择题
1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2 气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
B.加入NaOH溶液的体积是50mL
C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08mol
D.得到的金属氢氧化物的沉淀为3.12克
查看答案和解析>>
科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值,下列说法正确的是
A.Na2O2与水反应制O2,每生成0.25molO2转移电子数为1NA
B.等物质的量的N2和CO所含原子数均为2NA
C.在标准状况下,11.2L HCHO所含的分子数约为0.5NA
D.1molSO2与足量的O2反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A、NH4+、Ba2+、Br-、CO32-
B、Cl-、MnO4-、Fe2+、K+
C、K+、Na+、SO42-、MnO4-
D、Na+、H+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第四次考试化学试卷(解析版) 题型:选择题
某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种。若在该溶液中逐滴加入稀盐酸至过量无明显现象,并得到X溶液,对X溶液进行如下实验:(已知该题忽略水的电离,且原溶液中各离子浓度均为0.5mol•L-1)
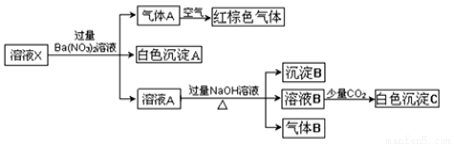
下列结论正确的是
A.原溶液中可能含有NO3-和Al3+
B.原溶液中一定存在NH4+、Fe2+、SO42-、Cl-
C.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
D.白色沉淀C可能是Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是( )
A.向醋酸钠水溶液中通入少量CO2 2CH3COO— + CO2+H2O = 2CH3COOH + CO32—
B.向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2 = 2Fe3++4Cl-+Br2
C.将铝片放入少量NaOH溶液中2Al+2OH-+2H2O =2AlO2-+3H2↑
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com