

| 实验数据1 | 实验数据2 | 实验数据3 | |
| 甲组 | 反应前氧化铜的质量 为m1g | 氧化铜反应后剩余固体的质量为m2g | 生成的氮气在标准状况下的体积为V1L |
| 乙组 | 实验前装置D的质量 为m3g | m4g | 生成的氮气在标准状况下的体积为V2L |
| ||
| ||
| m1-m2 |
| 16 |
| V1 |
| 22.4 |
| V1 |
| 22.4 |
| m1-m2 |
| 16 |
| 5V1 |
| 7(m1-m2) |
| V2 |
| 22.4 |
| m4-m3 |
| 18 |
| V2 |
| 22.4 |
| m4-m3 |
| 18 |
| 45V2 |
| 56(m4-m3) |
| 5V1 |
| 7(m1-m2) |
| 45V2 |
| 56(m4-m3) |


科目:高中化学 来源: 题型:
| ||
| A、反应中Cu2S只做氧化剂 |
| B、还原产物与氧化产物的物质的量之比为6:1 |
| C、Cu2O在反应中具有氧化性 |
| D、反应中被氧化的元素是S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18gNH4+中含有的电子数为10NA |
| B、常温常压下,10g氖气所含原子数为NA |
| C、1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA |
| D、标准状况下,2.24L己烷含有分子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑧ | B、①②⑥⑨ |
| C、③⑤⑥⑦ | D、①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
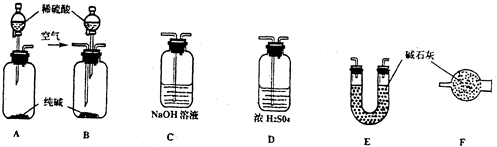
| 工业纯碱样品质量 | 反应前E的总质量 | 反应后E的总质量 |
| 5.5g | 43.9g | 46.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:

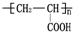 的单体,则A中所含官能团的名称是
的单体,则A中所含官能团的名称是 、
、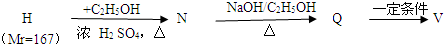
查看答案和解析>>
科目:高中化学 来源: 题型:
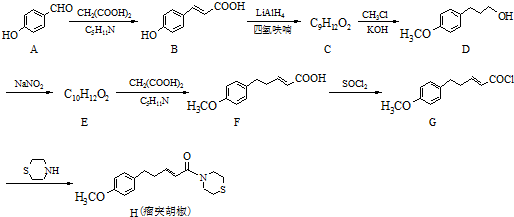
| ①O2 |
| ②ZnH2O |
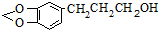 是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及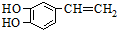 为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),
为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com