
| A. | 35Cl原子所含质子数为18 | |
| B. | 1mol的1H35Cl分子所含中子数为18个 | |
| C. | 7g的35Cl2气体的体积为2.24L | |
| D. | 35Cl2气体的摩尔质量为70g/mol |
分析 A.氯原子质子数为17;
B.1H35Cl分子含有中子数为0+35-17=18,进而计算中子物质的量,再根据N=nNA计算中子数目;
C.气体的所处温度、压强不确定,密度也未知,不能确定体积;
D.摩尔质量的单位为g/mol等.
解答 解:A.35Cl原子所含质子数为17,中子数为35-17=18,故A错误;
B.1H35Cl分子含有中子数为0+35-17=18,1mol的1H35Cl分子所含中子为18mol,含有中子数约为18×6.02×1023,故B错误;
C.3.5g的气体35Cl2的物质的量为0.05mol,由于气体的所处温度、压强不确定,密度也未知,不能确定体积,故C错误;
D.气体35Cl2的摩尔质量约是70g/mol,故D正确.
故选D.
点评 本题考查物质的量有关计算、原子构成、摩尔质量与气体摩尔体积等,比较基础,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 2倍 | B. | 1.5倍 | C. | 0.9倍 | D. | 0.5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、CO32- | B. | Ag+、K+、Cl-、NO3- | ||
| C. | Cu2+、SO42-、Na+、CO32- | D. | Ba2+、OH-、Mg2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | B. | 12 g金刚石的能量比12 g石墨的低 | ||
| C. | 金刚石比石墨稳定 | D. | 金刚石和石墨不能相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)=CO2(g)+4H2O(g)△H=-890 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-445 kJ/mol | |
| D. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| 时间/min | CO2 | H2O | CO | H2 |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
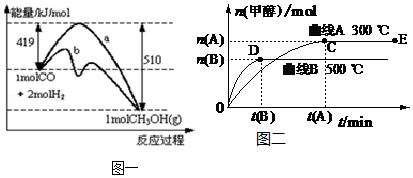
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com