
用氨碱生产NH4Cl和Na2CO3的主要过程是:在饱和NaCl溶液中,先通入足量的NH3气,然后再通入足量的CO2气体,析出NaHCO3晶体.主要反应有三步:
NH3+CO2+H2O→NH4HCO3
NH4HCO3+NaCl→NH4Cl+NaHCO3
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
若反应过程无损失,CO2可重复使用.
(1)通入NH3和CO2最适宜的体积比是(同温同压下)________;
(2)实际生产中,反应过程中需补充水和NaCl,补充水和NaCl的物质的量之比是________.
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
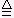 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O查看答案和解析>>
科目:高中化学 来源:0130 竞赛题 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com