
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.分析 (1)X元素与Y元素相邻,与X元素处于同一纵行的元素形成的单质的熔点、沸点随元素的原子序数的增大而增大,Y元素的含氧酸有多种,它的单质和氧化物都是强氧化剂,都可用作自来水的消毒剂,则X为Ar,Y为Cl;
(2)Y、Z、W三个原子的最外层共有11个电子,且三种元素形成的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,结合原子序数可知,Z为Al,W的最外层电子为11-7-3=1,则W为Na;
(3)Q、R两元素单原子形成的离子在水中不存在,与水作用使水溶液呈碱性,可知Q为O,R为N;
(4)在一定温度下,R、Q形成的化合物在密闭容器中可发生下列反应:2N2O3(g)═4NO(g)+O2(g);反应到达平衡后,若恒容条件下通入一定量的氦气,各组分浓度不变,平衡不移动;若在恒压条件下通入一定量的氦气,则平衡体系中压强减小,平衡正向移动.
解答 解:(1)X元素与Y元素相邻,与X元素处于同一纵行的元素形成的单质的熔点、沸点随元素的原子序数的增大而增大,Y元素的含氧酸有多种,它的单质和氧化物都是强氧化剂,都可用作自来水的消毒剂,则X为Ar,位于周期表0族,Y为Cl,实验室制备Y的单质的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O,
故答案为:0;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O;
(2)Y、Z、W三个原子的最外层共有11个电子,Y为Cl,且三种元素形成的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,结合原子序数可知,Z为Al,W的最外层电子为11-7-3=1,则W为Na,Y、Z、W三种元素的最高价氧化物对应水化物反应的离子方程式为H++Al(OH)3═Al3++3H2O、H++OH-═H2O、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:H++Al(OH)3═Al3++3H2O、H++OH-═H2O、Al(OH)3+OH-═AlO2-+2H2O;
(3)Q、R两元素单原子形成的离子在水中不存在,R的氢化物与水作用使水溶液呈碱性,可知Q为O,R为N,氮气的电子式为 ,W与R形成的化合物的化学式为 Na3N,含离子键,为离子晶体,
,W与R形成的化合物的化学式为 Na3N,含离子键,为离子晶体,
故答案为: ;Na3N;离子;
;Na3N;离子;
(4)在一定温度下,R、Q形成的化合物在密闭容器中可发生下列反应:2N2O3(g)═4NO(g)+O2(g);反应到达平衡后,若恒容条件下通入一定量的氦气,各组分浓度不变,平衡不移动,则转化率不变;若在恒压条件下通入一定量的氦气,则平衡体系中压强减小,平衡正向移动,则转化率增大,
故答案为:不变;增大.
点评 本题考查原子结构与元素周期律、位置与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识、化学平衡移动及化学键等综合应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:
一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
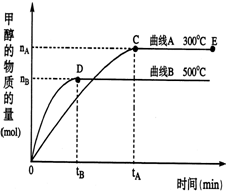 一定条件下,在体积为2L的密闭容器中,一氧化碳与氢气在催化剂作用反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).根据题意完成下列各题:
一定条件下,在体积为2L的密闭容器中,一氧化碳与氢气在催化剂作用反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).根据题意完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
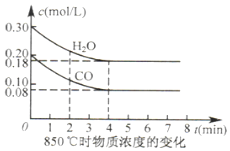 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用的实验仪器是容量瓶和烧杯 | |
| B. | 静置后所得液体上层呈紫红色 | |
| C. | 碘在CCl4中的溶解度比在水中的溶解度小 | |
| D. | 如果把CCl4加入碘的不饱和水溶液中,萃取碘的实验也可以成功 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com