
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100 mL量筒、250 mL容量瓶和托盘天平
C. 量取浓硫酸的体积为25.0 mL
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
科目:高中化学 来源: 题型:
【题目】已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是
组号 | 反应 温度/℃ | Na2S2O3 | H2SO4 | H2O | ||
体积/ mL | 浓度/ mol·L1 | 体积/ mL | 浓度/ mol·L1 | 体积/ mL | ||
A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯甲中盛有少量液态冰醋酸,烧杯乙中盛有NH4Cl晶体,在烧杯乙中再加入适量氢氧化钡晶体[Ba(OH)2·8H2O],搅拌,可观察到冰醋酸逐渐凝结为固体。下列有关判断正确的是

A.NH4Cl与Ba(OH)2·8H2O反应的焓变(ΔH)小于0
B.反应物的总能量高于生成物的总能量
C.反应中有热能转化为产物内部的能量
D.反应中断裂的化学键只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有50 mL 1.00 mol·L1 盐酸的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列说法不正确的是

A.该实验表明化学能可以转化为热能
B.NaOH溶液的浓度大于1.00 mol·L1
C.V=50 mL时,混合溶液的pH>7
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4 、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:

(1)物质X的化学式为________,操作1的名称:________
(2)写出A中主要成分的化学式:_____,在A中加入Y的离子方程式为:__________________
(3)工业废水中加入X所发生的离子方程式为:__________________________________;是否氧化还原反应____________(填“是”或“否”),如果是氧化还原反应,发生还原反应的是:______________(若非氧化还原反应则说明理由)。
(4)操作中的操作3是:___________、冷却结晶、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为_____(填字母)nm。
A.435 B500 C.580 D.605 E. 700
(2)元素S和Ca中,第一电离能较大的是_____(填元素符号),其基态原子核外电子排布式为_______。
(3)X射线衍射测定等发现,石膏(CaSO4 2H2O)中存在SO42-离子。SO42-离子的几何构型为_____,中心原子的杂化形式为________。
(4) 基态Ca原子中,核外电子占据最高能层的符号是____,占据该能层电子的电子云轮廓图形状为_____。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金展锰低,原因是_________________。
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρ g cm-3,则晶胞结构中最近的两个Ca2+间的距离为______ (列算式即可,用NA表示阿伏加德罗常数的数值)nm,与Ca2+紧邻O22-的个数为______。
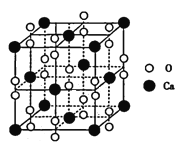
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
A.CH3COONa固体 B.NaOH溶液 C.(NH4)2SO4粉末 D.K2SO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17.下列说法正确的是 ( )
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. 元素的原子半径由小到大的顺序为r(Y)<r(Z)
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D. H2Z的熔点比H2W高,是因为H2Z分子内存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是( )
A. 地壳中金属元素的含量 B. 金属的延展性
C. 金属的导电性 D. 金属冶炼的难易程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com