
【题目】下列物质中含有自由移动的Cl-是( )
A. KClO3溶液 B. KCl溶液
C. 液态HCl D. NaCl固体
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】乙二酸(![]() )又名草酸,是生物体的一种代谢产物;现设计如下实验探究草酸分解反应的产物。
)又名草酸,是生物体的一种代谢产物;现设计如下实验探究草酸分解反应的产物。
资料查阅:
Ⅰ.草酸熔点为102℃,150~160℃升华,157℃时开始分解。在人体中C2O42-容易与钙离子形成草酸钙导致肾结石。
Ⅱ.PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O====CO2+2HCl+Pd(黑色粉末)。
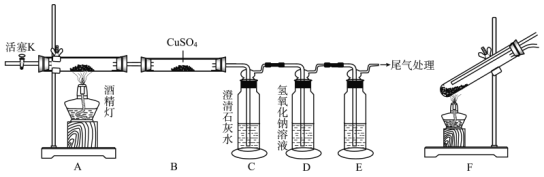
(1)A中盛放草酸的玻璃仪器的名称是_____________,实验中观察到B中CuSO4粉末变蓝,相关化学方程式为_____________。
(2)装置E中的试剂为_____________,当观察到_____________(填现象),可以证明有CO气体生成。
(3)下面是该实验过程中的相关操作,正确的操作顺序为_________(填入下列步骤的字母)。
A.向装置中通入适量N2 B.点燃酒精灯 C.检查装置气密性
D.装入相关试剂 E.再次通入N2并熄灭酒精灯
(4)为准确证眀A有CO2气体产生,需取少量C中沉淀于试管中,滴加过量盐酸并观察是否有气泡产生,其目的是_____________,草酸分解反应的化学方程式为_____________。
(5)实验过程中,学生提出装置A应改为装置F,请结合信息分析其原因是_____________;如果草酸粉末溅入眼睛里,应立即_____________,然后就医。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性无色溶液中能大量共存的离子组是的是
A. NH4+、Mg2+、SO42-、Cl-
B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl-
D. Na+ 、Ca2+、Cl -、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3判断下列物质的氧化能力由大到小的顺序是
A. Fe3+ > Cl2 > I2 B. Cl2 > Fe3+ > I2
C. I2 > Cl2 > Fe3+ D. Cl2 > I2 > Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是高中化学常见的的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。

已知:
①NaFeO2常温遇大量水会强烈水解,高温时不与水反应
②2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
③+6价的铬元素在强酸性条件下具有强氧化性,还原产物为Cr3+,强碱性条件下几乎没有氧化性;请回答下列问题:
(1)将矿石粉碎的目的是___________________________。
(2)高温灼烧时生成NaFeO2的化学方程式____________________________________。
(3)①滤渣1中有红褐色物质,滤渣1的成分为__________________(写化学式,下同),写出生成该物质反应的离子方程式___________________________。
②滤渣2的主要成分是__________________。
(4)若向Na2CrO4溶液中加入浓盐酸进行酸化,出现的现象为__________________
(5)生产后的废水中主要含有一定量的Cr2O72-,通常加一定量的绿矾进行净化并调节pH约为6,可生成两种难溶于水的沉淀,请写出该反应的离子方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知金属钠的活泼性非常强,甚至在常温时能和水发生反应2Na+2H2O===2NaOH+H2↑。现将9.2克钠、7.2克镁、8.1克铝分别放入100克10.95%的盐酸中,同温同压下产生气体的质量比是( )
A. 1∶2∶3B. 4∶3∶3C. 8∶6∶9D. 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题。
(1)利用VSEPR推断分子或离子的空间构型:![]() ___________;SeO3__________。
___________;SeO3__________。
(2)与SeO3互为等电子体的一种离子为_____(填化学式)。SCN-电子式_______。
(3)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是__。

(4)硒、溴与砷同周期,三种元素的第一电离能从大到小顺序为__________(用元素符号比较)。
(5) 已知常温下Ni(CO)4是无色液体,其构型为正四面体。则配位原子是______,晶体类型为__________,推测其______(填“难”或“易”)溶于水。
(6)CO2晶胞中,与CO2紧邻的CO2有_______个。
(7)酸性比较:H2SeO3______H2SeO4 ,原因_________________________________。
(8)向CuSO4溶液中滴加氨水,溶液先出现沉淀后沉淀溶解,写出沉淀溶解的离子方程式_____________________________,[Cu(H2O)4]2+易转化为[Cu(NH3)4]2+原因__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)开始进行时,CO的浓度为4 mol·L-1,N2的浓度为0,2 min后测得N2的浓度为0.6 mol·L-1,则此段时间内,下列反应速率表示正确的是
N2(g)+4CO2(g)开始进行时,CO的浓度为4 mol·L-1,N2的浓度为0,2 min后测得N2的浓度为0.6 mol·L-1,则此段时间内,下列反应速率表示正确的是
A. v(CO)=1.2 mol·L-1·s-1 B. v(NO2)=0.3 mol·L-1·min-1
C. v(N2)=0.6 mol·L-1·min-1 D. v(CO2)=1.2 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com