
| A. | 2:3 | B. | 1:1 | C. | 3:2 | D. | 2:1 |
分析 镁和铝分别与稀盐酸反应方程式为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余.
解答 解:镁和铝分别与稀盐酸反应方程式为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,
所以镁和铝都剩余,二者与酸反应生成氢气的量相等,所以同温同压下产生的气体的物质的量之比=0.05mol:0.05mol=1:1,
故选B.
点评 本题考查了根据方程式计算,题目难度不大,明确发生反应的原理为解答关键,注意根据反应物的量正确判断过量情况,为易错题,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 通过浓硫酸除去HCl中的H2O | |
| D. | 通过灼热的CuO除去H2中的CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物一定是酸 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 氯气溶于水后的溶液能导电,故氯气属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被还原的H2SO4为0.2moL | |
| B. | 反应中共转移电子0.1moL | |
| C. | 反应消耗了金属Cu6.4g | |
| D. | 生成的CuSO4配成500mL溶液,浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 气体发生装置 | 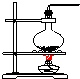 a |  b | 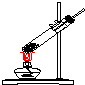 c |
| 气体收集装置 | 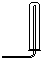 ① |  ② | 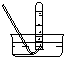 ③ |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(KJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl | |
| B. | CH2=CH2+HOCl$\stackrel{催化剂}{→}$HOCH2-CH2Cl | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | 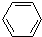 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ -Br+HBr -Br+HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
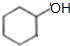
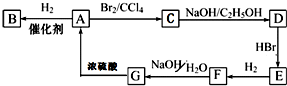 图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O反应类型是消去反应.由F生成G的化学方程式
+H2O反应类型是消去反应.由F生成G的化学方程式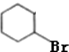 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr反应类型是取代反应.G发生催化氧化的化学方程式2
+NaBr反应类型是取代反应.G发生催化氧化的化学方程式2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com