
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
分析 (1)根据滴定管的结构、精确度以及量取的体积是两次读数之差;
(2)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算,V(标准)用两次的平均值;
解答 解:(1)滴定管液面读书为:19.90mL,消耗标准NaOH溶液的体积为:19.90mL-0.05mL=19.85mL,
故答案为:19.90mL;19.85mL;
(2)c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.1082×\frac{19.90+19.85}{2}}{20.00}$mol/L=0.1075mol/L;
答:盐酸浓度为0.1075mol/L.
点评 本题主要考查了中和滴定的操作与计算,难度不大,根据课本知识即可完成.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | NaOH固体称量时间过长 | B. | 盛放标准盐酸的滴定管用碱液润洗 | ||
| C. | 用酚酞作指示剂 | D. | 固体NaOH中含有Na2O杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
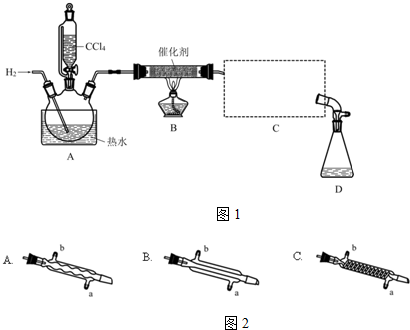
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
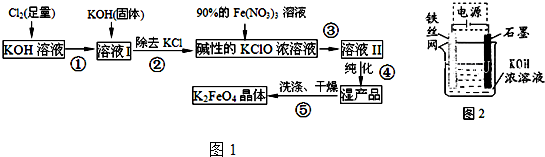
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
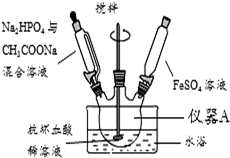 磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.
磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测氢氧化钠溶液的体积(ml) | 0.1000mol?L-1盐酸的体积(ml) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
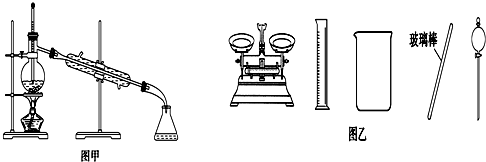
| A. | 闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动 | |
| B. | 将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置 | |
| C. | 用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签 | |
| D. | 配制500 mL 0.4 mol•L-1NaCl溶液,必要的仪器如图乙所示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com