
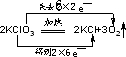 ,
,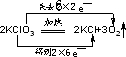 ;
;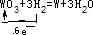 ,故答案为:
,故答案为: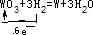 .
.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
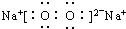
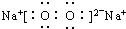
| ||
| ||
| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
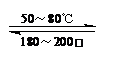 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H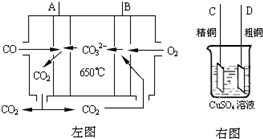
| 10 |
| 11 |
| ||
| 氢离子 |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
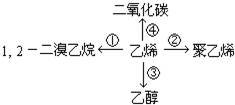 (1)写出实现下列变化的化学方程式,注明①②反应的类型.
(1)写出实现下列变化的化学方程式,注明①②反应的类型.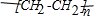
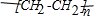
| 一定条件 |
| 一定条件 |
| ||
| ||
| 170℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | A | B | C | D | E | F | G |
| 性 质 结 构 信 息 |
制成的高压灯,发出的黄光透雾能力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达稳定结构. | 常温常压下是气体,元素的常见化合价为-1及多种正价. | +2价阳离子核外电子数与氖原子相同. | E和F是同主族元素,都有同素异形体.E的一种分子与F原子电子数目相同. | 常温下,其单质能与烧碱溶液反应放出气体,其氧化物能与强酸或强碱溶液反应. | |
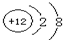
查看答案和解析>>
科目:高中化学 来源: 题型:
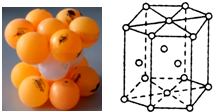 价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:
价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:| 等电子体类型 | 代表物质 | 空间构型 |
| 四原子24电子等电子体 | SO3 | 平面三角形 |
| 四原子26电子等电子体 | SO32- | 三角锥形 |
| 五原子32电子等电子体 | CCl4 | 四面体形 |
| 六原子40电子等电子体 | PCl5 | 三角双锥 |
| 七原子48电子等电子体 | SF6 | 八面体形 |
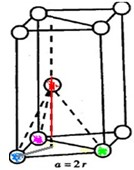 根据上述信息,回答下列问题:
根据上述信息,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com