
| A、Q=Q1+Q2+Q3 | ||
| B、Q=Q1-Q2-Q3 | ||
C、Q=
| ||
D、Q=
|
| ①+②×2+③×6 |
| 3 |
| Q1+2Q2+6Q3 |
| 3 |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②④ | C、①③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度升高.Na2CO3溶液的Kw和c(OH一)均会增大 |
| B、沉淀转化的离子方程式为CO32-十CaSO4=CaCO3+SO42- |
| C、盐酸溶液中,CaCO3的溶解性大于CaSO4 |
| D、Na2CO3溶液遇CO2后,阴离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与甲醇反应比金属钠与水反应更剧烈 |
| B、结合H+的能力CH3O->OH- |
| C、所得到溶液中K=c(CH3O-)×c(CH3OH2+) |
| D、所得到溶液中c(Na+)=c(CH3OH2+)+c(CH3O-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H20(g)═H2 (g)+l/202(g)△H=+242kJ.mol-l | ||
| B、2H2 (g)+02 (g)═2H20(1)△H=-484kJ.mol-l | ||
C、H2(g)+
| ||
| D、2H2(g)+02( g)═2 H2 0(g)△H=-242kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
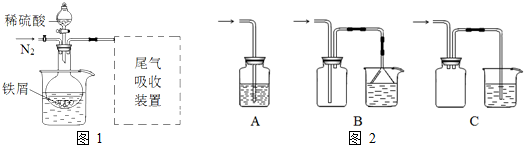
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com