
���� ��1���������ʵ���������ag���γ���Һ���Ϊ1Lʱ������c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{m}{MV}$��֪�����ʵ�Ħ������Խ�����γ���Һ��Ũ��ԽС������Ȼ��ơ��廯�ƺ͵⻯�Ƶ�Ħ��������С�ж���Һ������Ũ�ȴ�С��
��2�����յõ��ij���ΪAgI��AgBr��AgCl�Ļ���������NaI��NaBr��NaClת����AgI��AgBr��AgCl������ԭ�����е������ӱ������Ӵ��棬�����յõ��ij����������������������ʵ������ܺʹ���m=nM���������������
��� �⣺��1����������ag����Һ���Ϊ1Lʱ������c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{m}{MV}$��֪�����ʵ�Ħ������Խ�����γ���Һ��Ũ��ԽС������Ħ��������СΪ��NaI��NaBr��NaCl�������ɵ���Һ�����ʵ����ʵ���Ũ������ΪNaCl��
�����õ����Ȼ��ơ��廯�ƺ͵⻯��������Һ�����ʵ����ʵ���Ũ��������NaCl��
��2����Ӧ��������NaI��NaBr��NaClת����AgI��AgBr��AgCl������ԭ�����е������ӱ������Ӵ��棬�����յõ��ij����������������������ʵ������ܺʹ���������Ϊ�����������������ӵ������������108-23��g/mol����$\frac{ag}{150g/mol}$+$\frac{ag}{103g/mol}$+$\frac{ag}{58.5g/mol}$��=85��$\frac{1}{150}$+$\frac{1}{103}$+$\frac{1}{58.5}$��ag��
�����յõ��ij����������������������ʵ������ܺ�����ˣ���������Ϊ85��$\frac{1}{150}$+$\frac{1}{103}$+$\frac{1}{58.5}$��ag��
���� ���⿼�������ʵ���Ũ�ȵļ��㣬��Ŀ�Ѷ��еȣ���ȷ���ʵ���Ũ�ȼ�������Ӧ��ʵ��Ϊ���ؼ���ע���������ʵ��������ʵ���Ũ�ȡ�Ħ������֮��Ĺ�ϵ������������ѧ�������Ӧ��������


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3Cl | B�� | CH2Cl2 | C�� | CCl4 | D�� | HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu��OH��2+HCl��Cu��OH��2+CH3COOH | B�� | NaHSO4+NaOH��H2SO4+NaOH | ||
| C�� | NaHCO3+H2SO4��Na2CO3+HCl | D�� | BaCl2��Na2SO4��Ba��OH��2��CuSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
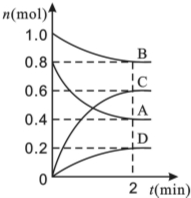 T��ʱ�����ݻ�Ϊ0.5L���ܱ������з���ijһ��Ӧ���Ҳ�ò�ͬʱ����������������A��B��C��D�����ʵ����仯��ͼ��ʾ����֪������A��B��C��Ϊ��̬��DΪ��̬������Ӧʱ���ȷ�Ӧ������Ҫ��ش��������⣺
T��ʱ�����ݻ�Ϊ0.5L���ܱ������з���ijһ��Ӧ���Ҳ�ò�ͬʱ����������������A��B��C��D�����ʵ����仯��ͼ��ʾ����֪������A��B��C��Ϊ��̬��DΪ��̬������Ӧʱ���ȷ�Ӧ������Ҫ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��֪������Ԫ��A��B��C��D����������Ӧˮ����ֱ�ΪX��Y��Z��W��A�Ƕ�������ԭ�Ӱ뾶����Ԫ�أ�������X��Z��W������Y��Ӧ��A��C��D��ԭ��������0.1 mol/LX��Z��W��Һ��pH��ͼ��ʾ������˵����ȷ���ǣ�������
��֪������Ԫ��A��B��C��D����������Ӧˮ����ֱ�ΪX��Y��Z��W��A�Ƕ�������ԭ�Ӱ뾶����Ԫ�أ�������X��Z��W������Y��Ӧ��A��C��D��ԭ��������0.1 mol/LX��Z��W��Һ��pH��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | B��D�γɵĻ������W������ͬ�Ļ�ѧ�������뾧������ | |
| B�� | C�⻯���ȶ��Դ���D�⻯���ȶ��ԣ�����ˮ��Һ������D����C | |
| C�� | B��C���γɵĻ�����ȿ�����B��C�ĵ������Ӧ�Ƶã�Ҳ���ɺ�B��CԪ�ؼ����ӵ�����Һ���Ӧ�Ƶ� | |
| D�� | A��B��C��D����Ԫ�ؾ��ڵ������ڣ�����ԭ�Ӱ뾶��������Ӧ�����ӵİ뾶���μ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϵ������¿���ѧ���������棩 ���ͣ�ѡ����
��Ӧ4NH3��g��+5O2��g��?4NO��g��+6H2O��g����2L���ܱ������н��У�1min��NH3������0.12mol����ƽ��ÿ����Ũ�ȱ仯��ȷ����
A��NO��0.06mol•L��1  B��H2O��0.002mol•L��1
B��H2O��0.002mol•L��1
C��NH3��0.002mol•L��1 D��O2��0.00125mol•L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и������ʼ䷴Ӧ���ܰ����ಽ��Ӧ�����ܵ����ӷ���ʽ��ȷ����( )
A��NaClO(aq)��ͨ�����SO2:ClO-+SO2+H2O=HClO+HSO3-
B��FeC12�ڿ����б�������4Fe2++O2+2H2O=4Fe3++4OH-
C��AlCl3(aq)��Ͷ������Na:Al3++4Na+2H2O=AlO2-+4Na++2H2��
D��FeBr2��Һ������ʵ�����Cl2��Ӧ��2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϵ�һ���¿���ѧ���������棩 ���ͣ�ѡ����
���ܱ������г���һ������N02��������Ӧ2N02(g) N204(g) ��H=һ57kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��N02�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���� ( )
N204(g) ��H=һ57kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��N02�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���� ( )
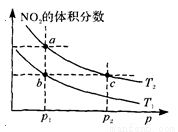
A��a��c����ķ�Ӧ���ʣ�a>c
B��a��b����N02��ת���ʣ�a<b
C��a��c�����������ɫ��a�cdz
D����a�㵽b�㣬�����ü��ȵķ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com